
- •Методичні вказівки до виконання практичних робіт з дисципліни «Теорія спікання дисперсних систем»
- •Практична робота №1 Вивчення твердофазних реакцій, що протікають при високотемпературному окускуванні тонкодисперсних залізорудних матеріалів
- •Практична робота №2 Термодинамічні розрахунки імовірності протікання твердофазних реакцій у процесах спікання металургійної сировини
- •Теоретичні передумови
- •Зміст роботи
- •Контрольні питання
- •Приклад виконання розрахунку
- •Варіанти завдань
- •Практична робота №3 Вивчення хімічних дефектів кристалічної решітки
- •Практична робота №4 Структурні дефекти кристалічної решітки
- •Контрольні питання
- •Практична робота №5 Вивчення дифузії при спіканні кристалічних тіл
- •3. Контрольні питання
- •Література
Практична робота №2 Термодинамічні розрахунки імовірності протікання твердофазних реакцій у процесах спікання металургійної сировини
-
Теоретичні передумови
До найважливіших величин, що характеризують хімічні системи, відносяться: внутрішня енергія U, ентальпія Н, ентропія S і енергія Гіббса (ізобарно-ізотермічний потенціал) G [2, с. 81-92; 3, с. 73-83]. Всі ці величини є функціями стану, тобто залежать тільки від стану системи, але не від способу, яким цей стан досягнутий.
При екзотермічних реакціях (тепло виділяється) внутрішня енергія системи зменшується (ΔU<0). Якщо внутрішня енергія системи зростає (ΔU>0) то процес супроводжується поглинанням енергії із зовнішнього середовища (ендотермічна реакція).
Якщо в результаті хімічної реакції система поглинула тепло Q і виконала роботу А, то зміна внутрішньої енергії ΔU=Q-А.
Відповідно до закону збереження енергії, ΔU залежить тільки від початкового й кінцевого стану системи, але не залежить від способу здійснення процесу (реакції). Навпроти, Q і А будуть різнитися залежно від способу здійснення процесу (функцією стану є тільки різниця Q і А, але не кожна з них окремо).
Якщо реакція протікає при постійному об’ємі (ΔV=0, ізохорний процес), то робота розширення системи (А=Р∙ΔV) дорівнює нулю. Якщо при цьому не відбуваються й інші види робіт, наприклад, електрична, то ΔU=QV, де QV – тепловий ефект реакції (тобто кількість поглиненої системою теплоти), що протікає при постійному об’ємі. Для екзотермічної реакції QV<0, для ендотермічної QV>0.
Для ізобарного процесу (ΔР=0), більш характерного для хімічних реакцій, зручніше користуватися не U, а Н=U+РΔV.
При постійному тиску ΔН=ΔU+РΔV.
Якщо при цьому ніякі інші роботи не відбуваються, ΔН=QР, де QР – тепловий ефект реакції, що протікає при постійному тиску.
Стандартний стан речовини при даній температурі - його стан у вигляді чистої речовини при нормальному атмосферному тиску 101325 Па, або 760 мм. рт. ст. Стандартні умови протікання реакції - стандартні зміни відповідних величин ΔUº і ΔНº [Дж].
Стандартна ентальпія реакції утворення 1 моля даної речовини із простих речовин звичайно виражається в кДж/моль.
Закон Гесса (1840): Тепловий ефект хімічної реакції залежить тільки від початкового й кінцевого станів речовин, що беруть участь у реакції, і не залежить від проміжних станів процесу. Наслідок: Стандартна зміна ентальпії хімічної реакції дорівнює сумі стандартних ентальпій утворення продуктів реакції за відрахуванням суми стандартних ентальпій утворення вихідних речовин. [Аналогічно для ΔS і ΔG].
Напрямки самовільного протікання хімічних реакцій визначаються спільною дією двох факторів: 1) тенденцією до переходу системи в стан з найменшою внутрішньою енергією (ентальпією); 2) тенденцією до досягнення найбільш імовірного стану, тобто стану, що може бути реалізовано найбільшим числом рівновірогідних способів (мікростанів).
Мірою першої (проявляється при всіх температурах однаковою мірою) тенденції є ΔН(ΔU) - зменшення яких сприяє самовільний плин ізобарного процесу (екзотермічний процес).
Мірою другої (проявляється тим сильніше, чим вище температура) тенденції являється ΔS[Дж/(моль∙К)]=Qобр./Т. S=k lgW, де k - коефіцієнт пропорційності; W - число рівновірогідних мікроскопічних станів, якими може бути реалізований даний макростан.
Ентропія зростає з підвищенням температури; при переході з кристалічного стану в рідкий й далі в газоподібний; при збільшенні числа газових молекул у ході реакції.
На відміну від ентальпії, ентропія утворення простої речовини не дорівнює нулю.
Функція, що одночасно відбиває вплив обох тенденцій на напрямок протікання хімічних процесів, називається енергією Гіббса: G=H-TS і характеризує максимальну роботу процесу.
Для ізобарно-ізотермічних процесів ΔG= ΔH-TΔS.
При сталості температури й тиску хімічні реакції можуть самовільно протікати тільки в такому напрямку, при якому енергія Гіббса системи зменшується (ΔG<0).
Використовуючи дані, що приводяться в довідниках термодинамічних властивостей речовин, можна розрахувати стандартну зміну цієї функції ΔG (ΔG=ΔН-ТΔS).
В принципі цю характеристику також можна використовувати для оцінки термодинамічної імовірності реакції. Однак до такої оцінки варто підходити з обережністю, тому що стандартні умови (25ºС та 1 атм.) не відповідають реальним умовам протікання процесу, при яких значення ΔGº може істотно відрізнятися від стандартних. Перерахунок стандартних термодинамічних величин на інші вимагає відомостей про теплоємність речовин, що беруть участь у реакції.
Термодинамічна імовірність – число мікростанів (мікророзподілів), якими може здійснюватися розглянутий мікророзподіл [2, c. 70-71].
Число мікророзподілів N часток по n станах (наприклад N часток в n відсіках) виражається формулою:
![]() (2.1)
(2.1)
де N1, N2, …, Nn – число часток у першому, другому, n-ному стані (відсіку). Причому N=N1+N2+…+Nn...
 Обчислимо
термодинамічну імовірність макростанів
а, б, в, г, д, наведених на рис. 2.1.
Обчислимо
термодинамічну імовірність макростанів
а, б, в, г, д, наведених на рис. 2.1.
![]()

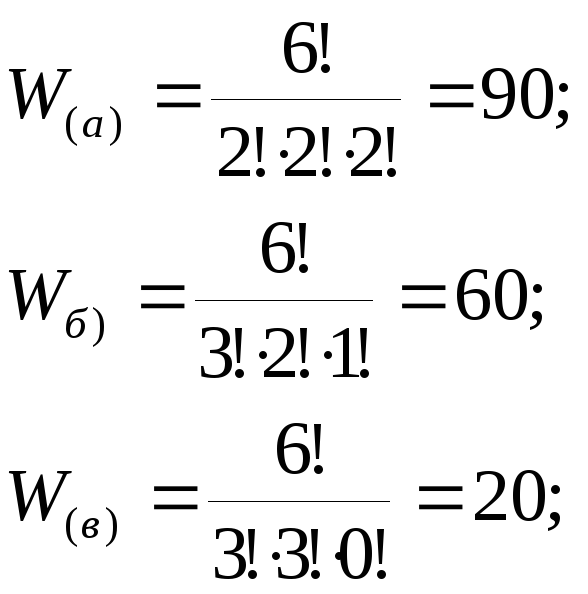
Рис. 2.1. Різні макророзподіли шести часток по трьох станах
Таким чином, найбільшу термодинамічну імовірність має рівномірний розподіл, він може здійснюватися найбільшим числом способів.
Больцман показав, що ентропія системи S може служити характеристикою термодинамічної імовірності даного стану системи W. Зв'язок між ними виражається рівнянням:
![]() (2.2)
(2.2)
де R – універсальна газова постійна;
NA – число Авогадро;
![]() - постійна
Больцмана.
- постійна
Больцмана.
Формула
(2.2) відноситься до числа чудових
співвідношень, породжених науковою
думкою [усього їх три, у тому числі
формула Ейлера (![]() )
і формула Енштейна (
)
і формула Енштейна (![]() )],
які зв'язують простим співвідношенням
величини, що володіють зовсім різними
властивостями, які відносяться до різних
матеріальних сутностей [фізичні величини
(S, R) з математичною (W)].
)],
які зв'язують простим співвідношенням
величини, що володіють зовсім різними
властивостями, які відносяться до різних
матеріальних сутностей [фізичні величини
(S, R) з математичною (W)].
![]() , (2.3)
, (2.3)
де
![]() -
модуль десяткового логарифма;
-
модуль десяткового логарифма;
![]() – коефіцієнт
пропорційності.
– коефіцієнт
пропорційності.
Число
е
є межа, до якої прагне (![]() )n
при необмеженому зростанні n;
)n
при необмеженому зростанні n;
![]() .
.
Абсолютно достовірною характеристикою імовірності протікання реакції в розглянутих умовах служить істинна зміна енергії Гіббса ΔG, зв'язана зі стандартною зміною ΔGº рівнянням ізотерми хімічної реакції.
У загальному випадку знак ΔG може не збігтися з ΔGº. Знак ΔGº буде збігатися зі знаком ΔG у двох випадках:
1) парціальні тиски складових реакції мало відрізняються від стандартного значення;
2) ΔGº велике за абсолютним значенням (практично більше 40 кДж).
Термодинамічну імовірність протікання реакції варто відрізняти від її практичної імовірності, під якою мають на увазі протікання реакції з помітною швидкістю. Наявність кінетичних труднощів може стати перешкодою до проведення реакції з необхідною швидкістю.
