
- •Тема: «Корабельные электрические аккумуляторы».
- •1. Назначение, принцип действия и основные технические характеристики химических источников тока
- •2. Устройство, электрохимические процессы, свойства и основные правила эксплуатации кислотных аккумуляторов.
- •3. Устройство, электрохимические процессы, свойства и основные правила эксплуатации щелочных аккумуляторов.
Утвержден на заседании ПМК
Протокол № 4 от 26 апреля 2010г.
Текст лекционного занятия № 1.8.
Тема: «Корабельные электрические аккумуляторы».
1. Назначение, принцип действия и основные технические характеристики химических источников тока
Химическим источником тока (ХИТ) называется устройство, в котором свободная, энергия пространственно разделенных окислительного и восстановительного химических процессов непосредственно превращается в электрическую энергию и передается во внешнюю цепь.
На надводных кораблях ХИТ используются для запуска дизелей и газовых турбин, а также в качестве резервных источников питания систем автоматизации, аварийных сетей освещения и для переносных аккумуляторных фонарей.
На АПЛ ХИТ (аккумуляторная батарея) служит в качестве аварийного источника энергии, с помощью которого производится пуск и расхолаживание реактора и снабжение электроэнергией минимального количества потребителей во время его остановки.
На неатомных ПЛ (ДПЛ) ХИТ (аккумуляторная установка) служит основным источником энергии и обеспечивает питание потребителей на всех режимах подводного хода. Таким образом, аккумуляторная батарея определяет длительность движения неатомной подводной лодки в подводном положении. Кроме этого, аккумуляторная батарея определяет и минимально необходимое время нахождения подводной лодки в надводном положении или в режиме РДП при ее зарядке.
В простейшем случае ХИТ состоит из двух разнородных материалов, погруженных в электролит. Совокупность электродов и электролита представляет собой электрохимическую систему:
(-) восстановитель | электролит | окислитель (+) Вертикальной чертой обозначают границу между пространственно разделенными электродами в электролите.
Электроды содержат в своем составе активные вещества - окислитель и восстановитель. В качестве электродов в ХИТ применяет либо металлы, либо окислы и гидроокиси металлов.
Электролиты корабельных ХИТ -.это растворы, в которых имеются подвижные ионы. К ним относятся растворы кислот и щелочей. В электролитах растворенное вещества распадаются на противоположно заряженные частицы -ионы. Распад молекул на ионы возможен в растворителях, которые имеют явно выраженную полярность молекул (например, в воде). Распад молекул на ионы происходит в результате взаимодействия ионов с диполями воды или другого растворителя (рис.1.1,а). Притянувшиеся к концам полярной молекулы диполи растворителя как бы растягивают молекулу, вследствие чего молекула из полярной превращается в ионную, а затем распадается на ионы. Распад молекул на ионы называется электролитической диссоциацией. При этом образуется два рода ионов, катионы и анионы.
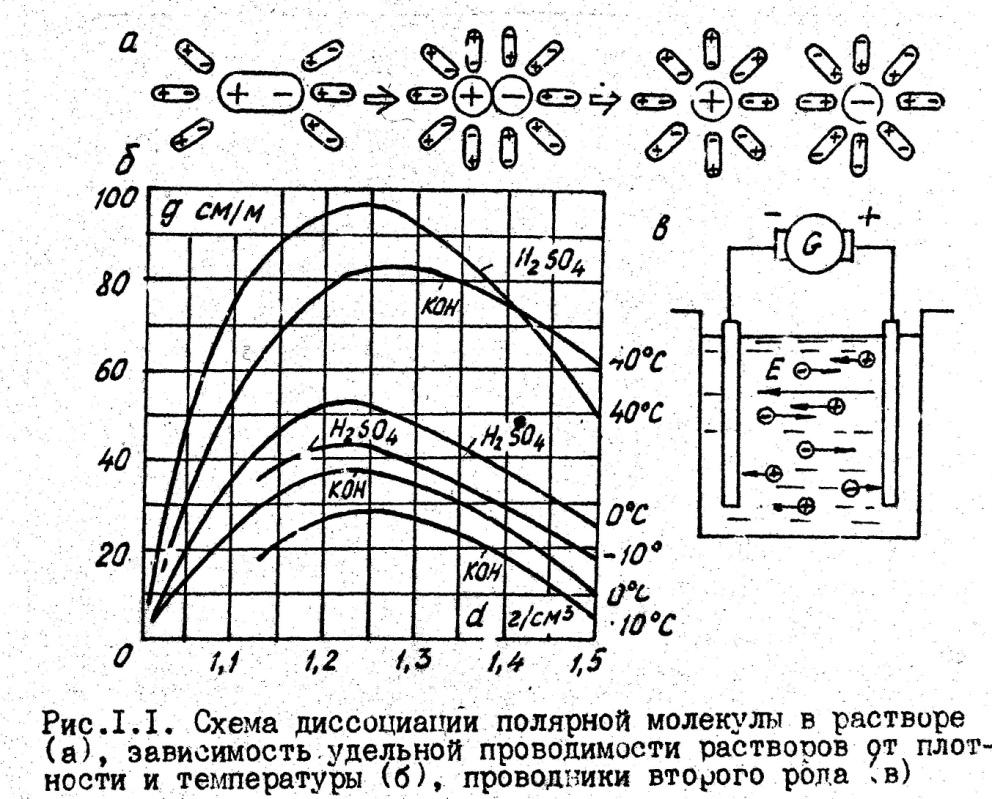
Катионами кислот и щелочей являются положительно заряженные кислотное и водные остатки. Степень диссоциации ά=n/N (где n-число диссоциированных из N молекул) зависит от температуры раствора, физико-химических свойств растворителя и растворенного вещества, а также концентрации раствора. Наиболее важной характеристикой для заданной электрохимической системы является концентрация раствора. Чем выше концентрация раствора, тем больше вероятность встречи ионов, тем меньше степень диссоциации. Например, раствор серной кислоты H2SO4, концентрация которого 95%, имеет ά=0,1, а при концентрации 0,5% - соответственное ά=0,9 (при одной и той же температуре 18° С).
На практике ищут оптимальные соотношения между степенью диссоциации и концентрацией электролита (рис.11,б). При эксплуатации ХИТ о концентрации раствора обычно судят по плотности электролита d (г/cm3) , а о степени диссоциации - по удельной проводимости электролита g [См/м]. Величина удельной проводимости зависит от природы электролита, его плотности и температуры. Приемлемая для эксплуатации плотность электролита находятся, как видно из рис.11,б, для электролитов на основе серной кислоты H2SO4 в пределах d=1,15-1,35, а для растворов на основе щелочи КОН- в пределах d=1,2-1,3.
Электролиты представляют собой проводники второго рода (рис.1.1, в). Электрический ток в них - это направленное движение ионов вдоль силовых линий электрического поля.
Электроды корабельных ХИТ, по современным представлениям, имеют, некоторое количество катионов и соответствующее количество электронов, способных свободно перемешаться в кристаллической решетке металла.
При соприкосновении металла с электролитом происходит взаимодействие электрических полей, образуемых, например, катионами кристаллической решетки и отрицательными полюсами дипольных молекул воды. В результате этого взаимодействия к ионам металла присоединяются молекулы воды. Это явление называется гидратацией. За счет энергии гидратации некоторые ионы металла проходят в раствор, а парные им электроны остаются в электроде и сообщают ему отрицательный заряд. Катионы металла располагаются в прилегающем к электроду слое электролита и сообщают ему положительный заряд. Образуется двойной электрический слой, а между электролитом и электродом возникает разность потенциалов.
Свойство металла отдавать свои ионы воде или электролиту называют электролитической упругостью растворения. Силы электролитической упругости растворителя стремятся послать ионы металла в раствор. Одновременно возникают силы противоположного направления, которые стремятся вернуть ион металла в электрод. Это силы напряженности электрического поля двойного электрического слоя и силы осмотического давления(увеличение числа ионов в растворе повышает его осмотическое давление). Когда действующие на заряды химические и электрические силы динамически уравновешиваются, устанавливается определенное значение так называемого гальвани-потенциала.
Гальвани-потенциал является физически реальной величиной, однако никакими средствами не может быть точно измерен. Присоединение любого измерительного устройства связано с образованием еще по крайней мере одной границы раздела, гальвани-потенциал которой будет искажать результаты измерений. Поэтому для большинства практических целей достаточно знать, насколько каждый гальвани-потенциал больше или меньше потенциала электрода сравнения.
Собственный потенциал электрода сравнения условно считают равным нулю. В качестве электрода сравнения обычно используют так называемый нормальный водородный электрод.
Электродный потенциал ( в отличие от гальвани-потенциала) - это напряжение разомкнутой цепи, включающей данный электрод и электрод сравнения. Располагая электродные потенциалы, измеренные относительно нормального водородного электрода, в порядке возрастания их величины Е0 получают электрохимический ряд напряжений (табл. 1.1):

При отрицательном нормальном электродном потенциале электрода Е0 самопроизвольным процессом будет окисление, а при положительном потенциале - восстановление.
Важно отметить, что величина электродного потенциала зависит от вещества электрода, вещества и концентрации электролита, его температуры, но не зависит от размеров, массы и формы электродов.
Для создания электрохимической системы с максимальной ЭДС следовало бы взять электроды с максимальной разностью нормальных электродных потенциалов. Однако, это не всегда целесообразно из-за стоимости и безопасности обслуживания ХИТ. Например, для отрицательного электрода нельзя использовать щелочные металлы К, Na поскольку они бурно реагируют с водой а для положительного -золото Аu по причине высокой wены материала.
Принцип действия ХИТ. Если два электрода с разными потенииалами, погрузить в электролит и разомкнуть внешнюю цепь то разности потенциалов между электродами не появится, поскольку потенциал каждого электрода уравновешивается в электролите потенциалом приэлектродного слоя. При замыкании внешней электрической цепи ХИТ под действием разности потенциалов между электродами электроны вне электролита будут перемещаться в сторону электрода с более высоким потенциалом. При этом равновесие зарядов в приэлектродных слоях нарушается. Между электродами в электролите возникает электрическое поле. Ионы электролита под действием сил этого поля начнут перемещаться а изменение числа электронов на электродах нарушит равновесие на границе электрод-раствор. Так, на отрицательном электроде часть катионов перейдет в раствор, а на положительном электроде такое же количество катионов выделится из раствора и за счет переместившихся по внешней цепи электронов превратится в нейтральные атомы. Таким образом на отрицательном электроде происходит процесс окисления а на положительном - процесс восстановления. Химические реакции, в которых участвуют или в ходе которых в металле образуется свободные электроны, называют электрохимическими, или электродными реакциями. Эти реакции поддерживают продолжительный переток электронов во внешней цепи. В целом получается замкнутая электрическая цепь, но как только внешняя цепь размыкается, то протекание обеих электродных реакций прекращается.
Возникновение электродных потенциалов на границе электрод - электролит лежит в основе принципа действия ХИТ.
Вещества, входящие в состав электродов и участвующие в токообразующих электрохимических процессах ХИТ называются активными веществами.
Процесс передачи электрической энергии от химического источника тока во внешнюю цепь называют разрядом. Зарядом называют процесс передачи электрической энергии от внешнего источника к химическому источнику тока с целью восстановления первоначальных активных веществ.
ХИТ разделяются на группы:
- источники разового действия, или первичные (гальванические) элементы. В них заложен запас активных веществ, после израсходования которого они теряют работоспособность (к примеру, батарейки переносных фонарей);
-
источники многократного действия или аккумуляторы. Корабельные аккумуляторы после разряда допускают повторный заряд путем пропускания тока в обратном направлении от внешнего источника;
-
топливные элементы, в которых в процессе работы непрерывно подводятся новые порции реагентов и одновременно удаляются продукты реакции. Такие элементы могут работать непрерывно в течение длительного времени, но на кораблях в настоящее время не применяются.
Основные технические характеристики ХИГ:
- электродвижущая сила (ЭДС) Е - разность электродных потенциалов источника при разомкнутой внешней цепи, [в];
-
полное внутреннее сопротивление R0 , включающее в себя сопротивление электродов и электролита, а также сопротивление поляризации. Величина сопротивления R0 невелика и составляет 0,01-0,0001 Ом;
-
емкость - количество электричества Q (или величина тока I ), которое проходит через внешнюю цепь за время t: C=
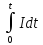 или
С=It
при
I=const.
Емкость
ХИТ измеряется в ампер-часах (1А·ч=3600.
К). Различают разрядную
(при полном разряде), зарядную (полученную
в течение заряда) и номинальную емкости
(под номинальной емкость Сном
понимают
емкость, гарантируемую заводом-изготовителем
при определенном режиме разряда);
или
С=It
при
I=const.
Емкость
ХИТ измеряется в ампер-часах (1А·ч=3600.
К). Различают разрядную
(при полном разряде), зарядную (полученную
в течение заряда) и номинальную емкости
(под номинальной емкость Сном
понимают
емкость, гарантируемую заводом-изготовителем
при определенном режиме разряда); -
энергия разряда (заряда), под которой понимается энергия, отдаваемая источником при разряде (получаемая при заряде;. Энергия разряда (заряда) определяется выражением W=
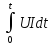 и выражается в ватт-часах
(1
Вт·ч=3600
Дж);
и выражается в ватт-часах
(1
Вт·ч=3600
Дж); -
удельная емкость (энергия) - емкость (энергия) разряда на единицу объела или массы;
-
-отдача по энергии (емкости) ήw – отношение энергии (емкости) разряда к энергии (емкости) заряда (%);
- саморазряд - химические процессы, происходящие на одном или на обоих электродах с использованием активных веществ при разомкнутой внешней цепи. Мерой саморазряда является относительная потеря емкости за единицу времени;
-
сохраняемость - время, в течение которого источник годен к употреблению;
-
срок службы - время, в течение которого источник пригоден для работы. Срок службы характеризуется числом условно-полных циклов зарядов и разрядов (УПЦ), в течение которых источник способен отдавать энергию не ниже допустимой. Величина УПЦ является одной из контрольных характеристик при эксплуатации;
-
напряжение и ток разряда (заряда) Uраз, Iраз (Uзар,Iзар).
