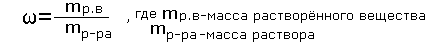- •2) Химические свойства оснований в свете теории электролитической диссоциации.
- •3) Хим. Свойства кислот в свете теории электр. Диссоциации.
- •4) Хим. Свойства солей в свете теории электр. Диссоциации.
- •5) Возникновение и развитие атомно - молекулярного учения.
- •6) Закон сохранения массы и энергии. Закон постоянства веществ. Закон эквивалентов. Закон авогадро.
- •7) Основные понятия химии: атом, молекула, хим. Элемент, вещество.
- •8) Модели строения атома: модель резерфорда, теория бора.
- •9) Открытие периодического закона . Периодическая система химических элементов:структура, периодическое изменение свойств элементов по периодам и группам.
- •10)Химическая связь. Основные виды химической связи.
- •11) Основные характеристики химической связи: длинна связи, энергия связи, валентные углы, полярность, дипольный момент, степень ионности, степень окисления.
- •13) Электронные структуры атомов элементов : энергетические уровни и подуровни электронов в атоме.
- •2. Кислотные и оснόвные оксиды
- •18) Ионно -обменные реакции. Условия необратимости ионно-обменных реакций. Ионно-обменные реакции между ионами в растворах электролитов.
- •21) Растворы, классификация и свойства растворов. Основные свойства растворов и их классификация
- •22)Способы выражения концентрации растворов.Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •23) Гидролиз солей . Ионное произведение воды , рН растворов.
- •Кислота или щелочь?
- •24)Электролиз. Применение электролиза.
- •25)Комплексные соединения. Координационная теория Вернера . Номеклатура комплексных соеденений . Классификация коплексных соединений .
- •1. КоординационнАя теориЯ Вернера
- •1. 1. Основные понятия координационной теории Вернера
- •1. 2. Определение заряда основных частиц комплексного соединения
- •1. 3. Номенклатура комплексных соединений
- •26) Понятие о химической термодинамике. Экзо- и эндотермические реакции. Применение электролиза в технике
- •Ионное произведение воды. PH раствора
- •Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •Основные свойства растворов и их классификация
- •Классификация органических соединений
- •История развития органической химии
- •Строение органических соединений
- •Общая характеристика реакций органических соединений
- •Возникновение органических соединений
- •[Править] История
- •[Править] Классификация органических соединений
- •[Править] Правила и особенности классификации
- •[Править] Основные классы органических соединений
- •[Править] Строение органических молекул
- •[Править] Строение органического вещества
- •[Править] Особенности органических реакций
- •[Править] Определение структуры органических соединений
Смешивание растворов с разными концентрациями
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2 . Образовался раствор (№3) с массовой долей растворенного вещества w3 . Как относятся друг к другу массы исходных растворов?
Решение Пусть w1 > w2 , тогда w1 > w3 > w2 . Масса растворенного вещества в растворе №1 составляет w1 · m1, в растворе №2 – w2 · m2. Масса образовавшегося раствора (№3) – (m1 – m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w 1 · m1 + w 2 · m2 = w3· (m1 + m2) w1 · m1 + w 2 · m2 = w3 · m1 + w3 · m2 w 1 · m1 – w3 · m1 = w3 · m2 – w2 · m2 (w1– w3) · m1 = (w3– w2) · m2 m1 / m2 = (w3– w2 ) / (w1– w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста :

m1 / m2 = (w3 – w2) / (w1 – w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 – w3), w1 > w3 и (w3 – w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.

5 / 30 = m1 / (210 - m1) 1/6 = m1 / (210 – m1) 210 – m1 = 6m1 7m1 = 210 m1 =30 г; m2 = 210 – m1 = 210 – 30 = 180 г
Разбавление раствора
Исходя из определения массовой доли, получим выражения для значений массовых долей растворенного вещества в исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (ρ1 · V1) откуда V1= m1 /( w1 ·ρ1) w2 = m2 / (ρ2 · V2) m2 = w2 ·ρ2 · V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2 ·ρ2 · V2) / (w1 · r1) m2 = w2 ·ρ2 · V2 или
|
w1 · ρ1 · V1 |
= |
w2 · ρ2 · V2 |
|
m1(раствор) |
|
m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
Пример Определите массу 3%-ного раствора пероксида водорода, который можно получить разбавлением водой 50 г его 3%-ного раствора.
m1(раствор) / m2(раствор) = w2/ w1 50 / x = 3 / 30 3x = 50 · 30 = 1500 x = 500 г
РАСТВОРИМОСТЬ ВЕЩЕСТВ.СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ.
Растворами называют однородные смеси переменного состава, содержащие два или более вещества. Из составных частей раствора одно вещество считается растворителем, остальные- растворёнными веществами. Для каждой пары растворённое вещество-растворитель существует граница смешивания, которая характеризует растворимость вещества. Растворы могут быть насыщенными и ненасыщенными. Насыщенным называется такой раствор, в котором растворяемое вещество не переходит в раствор. Если содержание вещества в растворе меньше растворимости этого вещества, то такой раствор является ненасыщенным. Количественный состав раствора может быть количественно задан несколькими способами.Мы рассмотрим два способа выражения концентраций: процентная (массовая доля растворённого вещества) и молярная концентрации.
|
Процентная концентрация, массовая доля растворённого вещества |
|
Массовая доля растворённого вещества-это отношение массы растворённого вещества к массе раствора.
Для расчёта процентной концентрации используется формула:
Раствор состоит, как было сказано выше, из растворённого вещества и растворителя. Массу раствора можно определить по формуле:
Эти формулы используются для решения различных задач на рвсчёт концентрации. |
|
Молярная масса |
|
Молярная концентрация - это величина численно равная отношению количества растворённого вещества к объёму раствора. Единица измерения моль/л.
Задача:98 г серной кислоты H2SO4 разбавили до объёма 2 литра. Определите молярную концентрацию кислоты в растворе. 1.Необходимо найти количество вещества, соответствующее 98 г серной кислоты. Молярная маса серной кислоты равна М(H2SO4)=1*2+32+16*4=98 г/моль, ν=m/M=98г/98г/моль=1 моль. 2.По выше приведённой формуле определяем молярную концентрацию с=1моль/2л=0,5 моль/л. Ответ: 0,5 моль/л. |
При решении задач часто используется формула, которую вы изучали по физике, формула плотности. Я её здесь приведу.