
- •Раздел 1. Металлургия магния
- •Тема 1.1 Свойства магния и области его применения
- •§ 1 История открытия магния и развития магниевого производства
- •§ 2 Основные свойства магния
- •§ 3 Применение магния
- •§ 4 Руды и минералы магния
- •Тема 1.2 Технологические схемы получения хлорида магния
- •1.2.1 Карналлитовая атс
- •3. Обезвоживание в хлораторах
- •2)Степень гидролиза
- •1.2.2 Хлормагниевая атс
- •1 Вариант – хлорирование магнезита MgCo3
- •2 Вариант – Обезвоживание бишофита
- •Тема 1.3 Теоретические основы электролитического получения магния
- •§ 1 Виды магниевых электролитов. Состав электролитов.
- •§ 2 Свойства магниевых электролитов
- •1) Вода
- •2)Соли железа
- •3) Марганец
- •4) Титан
- •5) Сульфаты
- •6) Кремний
- •8) Оксид магния
- •9) Никель, хром и алюминий
- •Тема 1.4 Технология электролитического получения магния
- •§ 1 Конструкции электролизеров
- •§ 2 Циркуляция электролита
- •§ 3 Размещение электролизеров
- •§ 1 Пуск электролизера
- •§ 2 Ремонт электролизера
- •§ 3 Обслуживание электролизеров в процессе электролиза
§ 2 Свойства магниевых электролитов
Свойства электролита зависят от состава исходного сырья, методов переработки, технологической схемы питания ванн сырьём.
Расплавленные соли относятся к классу ионных жидкостей, так как основными структурными единицами в них являются ионы. Свойства расплавленных солей связаны с их структурой и молекулярным составом. В системах хлорида магния с другими хлоридами наблюдается глубокое взаимодействие в жидком состоянии, приводящее к появлению в расплаве комплексных ионов (комплексообразование).
Плавкость
Cистема КСl * MgCl2
В ней существует 2 конгруэнтно плавящихся соединения (с разложением):
КСl * MgCl2 с tПЛ = 490 0С,
2КСl * MgCl2 с tПЛ = 430 0С
и 2 инконгруэнтно плавящихся соединения:
3KCl*2MgCl2 tПЛ = 442 0C
4KCl*MgCl2 tПЛ = 430 0C
Система NaCl*MgCl2 более легкоплавкая
В ней существует 3 инконгруэнтно плавящихся соединения:
2NaСl * MgCl2 с tПЛ = 480 0С;
NaСl * MgCl2 с tПЛ = 465 0С;
NaСl * MgCl2 с tПЛ = 465 0С

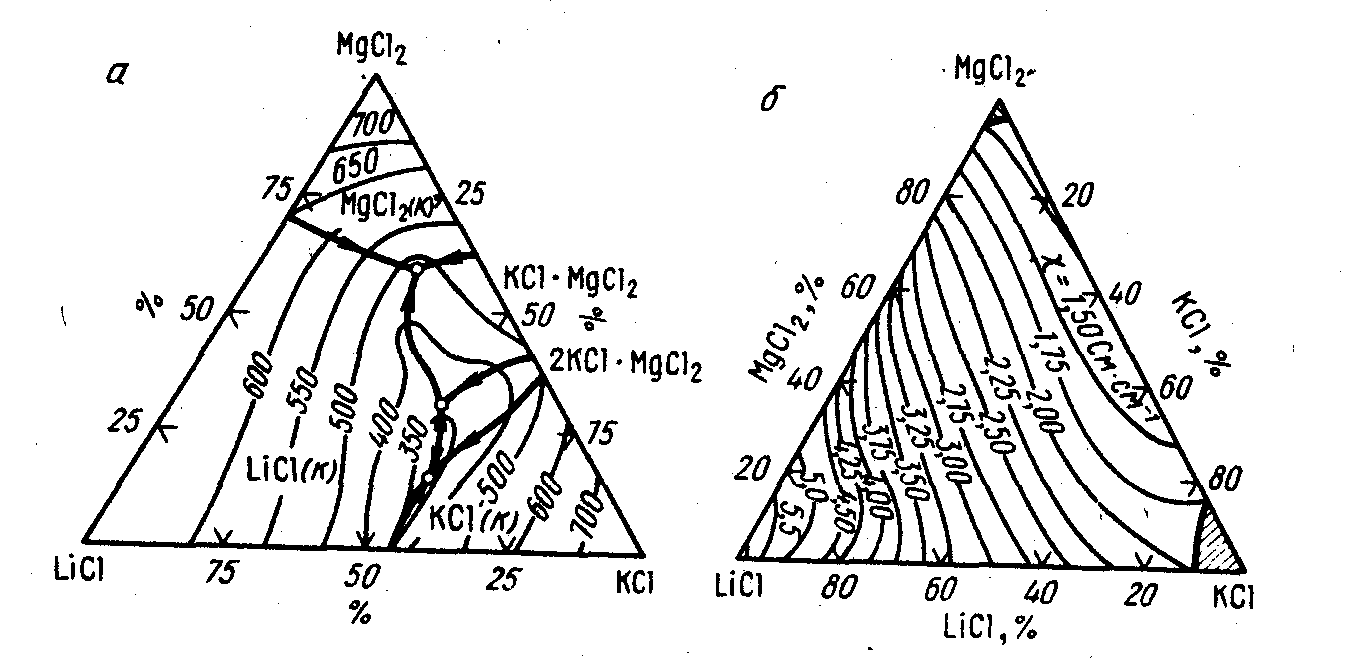
Электропроводность (χ) (См / м), (Ом-1 * см-1)
Это одно из важнейших свойств электролита, оказывающее существенное влияние на показатели работы магниевого электролизера. Увеличение электропроводности электролита позволяет увеличивать плотность тока и межполюсное пространство – расстояние между анодом и катодом. Поэтому процесс электролиза можно интенсифицировать без увеличения удельного расхода электроэнергии.
Наиболее высокую электропроводность имеют хлориды лития и натрия. Значение электропроводность увеличивается с повышением содержания KCl и NaCl. Наименьшую электропроводность имеет хлорид магния.
|
|
Удельная электропроводность, См / м |
|
LiCl |
5.86 |
|
NaCl |
3.54 |
|
KCl |
2.42 |
|
MgCl2 |
1.7 |
В последнее время ведутся разработки электролитов с применением солей лития. Это может дать существенный экономический эффект.
В целом промышленный электролит имеет электропроводность 1,7 – 2,2 См/м.
Ток к катоду в электролите переносится ионами калия (70 – 80 %), частично ионами магния. Концентрация ионов магния возрастает у анода и убывает у катода, а концентрация ионов калия – наоборот. С повышением концентрации KCl в расплаве доля тока, переносимая ионами магния, уменьшается. При концентрации хлорида магния меньше 28 % мол. Весь ток к катоду переносится ионами калия.
На перенос тока сильно влияет комплексообразование солей в расплаве. Комплексные ионы менее подвижны.
С повышением температуры проводимость хлоридных расплавов увеличивается.
Теплопроводность
Это способность передавать тепло от более нагретых частей к менее нагретым. Характеризуется тепловым потоком.
q = - λ * (dТ / dх),
где λ - коэффициент теплопроводности, Вт / (м * 0С),
dТ / dх – градиент температуры, 0С.
Перенос ионов
Числом переноса ионов называется доля его участия в переносе тока (t), доли единиц.
Число переноса катионов t+ = υ+ / (υ+ + υ-)
Число переноса анионов t- = υ- / (υ+ + υ-),
где υ+ и υ—скорости движения катионов и анионов в электрическом поле, м/с.
Диффузия
Это перенос вещества через неподвижный слой δ (дельта) под действием разности концентраций (с) по обеим сторонам слоя. Скорость переноса или диффузионный поток (ј) описывается уравнением:
ј = D (∆c / δ)
где D – коэффициент диффузии, м2/с;
ј быстро растет с увеличением температуры, это приводит к снижению выхода по току η, т. к. растворимость металла в электролите увеличивается.
Вязкость
Влияет на скорость всплывания капель магния, на циркуляцию электролита, на выделение и характер движения пузырьков хлора. При уменьшении вязкости скорость всплытия капель магния увеличивается, ускоряется процесс оседания шлама. При увеличении температуры вязкость уменьшается. Увеличивает вязкость расплава повышение концентрации хлоридов магния, бария и кальция.
Напряжение разложения хлорида магния в расплавленных хлоридах.
Вычисляется по формуле:
Еразл = - G / z * F
где Е - напряжение разложения при Т, К;
G –энергия Гиббса, дж / моль;
z - валентность магния;
F - число Фарадея.
Напряжение разложения зависит от состава расплава. С уменьшением содержания хлорида магния в расплаве напряжение разложения его возрастает. Если бы все компоненты электролита вели себя в его расплаве как индивидуальные, не взаимодействующие между собой вещества, то порядок выделения металлов был бы такой: Fe, Al, Ti, Mn, т.е. в начале выделялись бы наиболее электроположительные металлы. Напряжение разложения соли в растворе существенно повышается и потенциал разряда смещается в электроотрицательную сторону. Увеличение напряжения разложения хлорида магния определяется сдвигом потенциала катода в электроотрицательную сторону за счет снижения активности нона магния.
Напряжение разложения хлорида магния, измеренное на промышленных электролизерах, где концентрация хлорида магния не превышает 10-20 %, составляет 2,7-2,8 В. При температуре плавления оно составляет 2,507 В.
Напряжение разложения может быть вычислено:
Е = Е0 – (R * T / z * F) * ln a,
где Е0 – напряжение разложения чистого хлорида магния, в;
а – активность хлорида магния, доли единицы.
ВОПРОСЫ
1. Как влияют компоненты электролита на его электропроводность?
2. Какими ионами переносится ток в расплавах?
3. Как влияет на растворимость магния температура добавки хлоридов?
4. Какое напряжение разложения на промышленных электролизерах?
5. Как изменится напряжение разложения при уменьшении концентрации хлорида магния? Почему?
6. Как влияет плотность и вязкость электролита на потери магния при электролизе?
7. Как влияет поверхностное натяжение электролита на потери магния при электролизе?
Растворимость магния и хлора в электролите
Потери магния в процессе электролиза определяются взаимодействием металла с компонентами электролита. Магний в расплавах, содержащих хлорид магния, растворяется за счет образования ионов низшей степени окисления:
Между магнием и его ионами в расплаве устанавливается равновесие. Магний может растворяться в расплавленных солях в виде атомов с образованием атомно-молекулярного раствора. С повышением температуры расплава растворимость магния увеличивается. С добавками LiС1, КС1, NаС1,СаС12, ВаС12 растворимость магния в расплаве падает. Сильнее всего действуют добавки хлорида калия, в меньшей степени - хлоридов натрия и лития.
Потери магния также связаны с растворимостью хлора, выделяющегося на аноде, с его диффузией в объем электролита. Растворимость хлора в хлоридных расплавах растет с температурой.
Кинетика электродных процессов
Основными процессами на электродах магниевого электролизера является разряд ионов магния и хлора. Расчетные потенциалы:
Mg+ + e = Mg φ = - 2,111 В
Mg 2+ + 2e = Mg φ = - 2,675 В
Mg2+ + e = Mg+ φ = - 3,239 В
Потенциал катода при нормальном процессе электролиза магния составляет 2,7 - 2,8 В. При этом потенциале на катоде будут идти в основном два первых процесса, вероятность протекания реакции перезаряда ионов магния незначительна.
Скорость протекания всех этих катодных реакций определяется концентрацией ионов в приэлектродном слое. Возможна их диффузия в глубь электролита, содержащего кислород и хлор, что влечет за собой их окисление.
При электролизе магния возможен совместный разряд ионов магния и щелочного металла. Это наблюдается при уменьшении содержания хлорида магния до некоторого предела. В этом случае из-за концентрационной поляризации магния потенциал катода сдвигается к потенциалу разряда щелочного металла.
При введении в хлоридный расплав фторидов (NаF,СаF2) потенциал катода смещается в более электроотрицательную сторону, образуются менее подвижные фторидные комплексы . Повышается вероятность совместного разряда ионов магния и щелочного металла в присутствии в электролите заметных количеств фтор- нона.
На графитовом аноде магниевой ванны в основном идет только разряд ионов хлора по реакции:
2Сl- - 2е = Сl2
Иногда на графитовых анодах при больших плотностях тока может наблюдаться поляризация, которую связывают с адсорбцией атомов хлора графитом и дальнейшей замедленной десорбцией молекулярного хлора. На графитовом аноде могут протекать и побочные процессы, в основном связанные с выделением оксидов углерода. Анодный эффект при электролизе хлорида магния независимо от состава электролита не наблюдается.
ВОПРОСЫ
1. Какие реакции протекают на катоде и аноде?
2. Из каких материалов сделаны электроды магниевых электролизеров? Почему1?
3. В каком случае возможен совместный разряд ионов магния и щелочного металла?
4. Расходуется ли анод в магниевых электролизерах?
Образование шлама в электролите
При осаждении магния в результате побочных процессов, протекающих в электролизере, из электролита осаждаются различные вещества, постепенно накапливающиеся на подине ванны. Этот осадок образует шлам - вязкую массу черного или темно-бурого цвета. Состав шлама, %:
МgО 20-35, Мg 2-5, Fе 2-6, SiO2 2-4, TiO2 0,8-2, С 0,4-1,0, оксиды других металлов 3-8 %.
При извлечении шлама вместе с ним увлекается часть электролита, пропитывающая твердую часть шлама. Извлеченный из шлама электролит составляет 60-70% от массы шлама. Количество шлама зависит от состава и качества используемого сырья, от состава электролита, от соблюдения нормального хода электролизера и составляет на 1кг магния - 0,03-0,25 кг при питании электролизера безводным карналлитом. Наименьшее количество шлама образуется при питании ванны возвратным хлоридом магния титанового производства.
Одновременно с процессом образования шлама идет процесс его хлорирования. Положительной в этом процессе является реакция перехода оксида магния в хлорид - магния. Скорость хлорирования повышается с увеличением содержания КС1 и NаС1 и понижается концентрация СаС12 и ВаС12 в расплаве. Хлорирование металлических примесей и их оксидов ведет к тому, что они снова переходят в нерастворимой форме в расплав, загрязняя получаемый металл и ухудшая показатели электролиза.
ВОПРОСЫ
1. Как попадают примеси в электролит?
2. Какие примеси оказывают наиболее вредное влияние на процесс электролиза?
3. Почему транспортировку сырья для производства магния осуществляют в закрытых емкостях?
4. Что такое пассивация катода? В каких случаях происходит пассивация катода?
5. Какое влияние оказывают примеси железа и марганца на процесс электролиза?
6. При наличии каких примесей магний выделяется в сильно диспергированной форме?
7. Для чего в некоторых случаях в электролит загружают влажную поваренную соль?
8. Какой состав шлама? От чего зависит количество шлама?
9. Вследствие каких процессов магний может оказаться в составе шлама? К чему это приводит?
Показатели (недоделано)
Параметры электролиза магния
Температура электролиза – 680 – 720 0С
МПР – 6 – 8 см
Выход по току – 70 – 85 %
Напряжение 4,4 – 6,4 В
Сила тока – до 150 кА
Плотность тока анодная - 0,4 – 0,8 А / см2
Плотность тока катодная - 0,3 – 0,4 А / см2
Расход электроэнергии – 11 – 16 кВт*ч / кг Mg
Съем магния 60 – 120 кг/сут с 1 м2 подины
Задача № 1 Определить массу магния, полученного при электролизе, если выделилось 15 м3 анодных газов. Содержание хлора в анодных газах составляет 85 %, остальное воздух. Плотность хлора 3,24 кг/м3, плотность воздуха 1,29 кг/м3
Решение:
Объем анодных газов 15 м3. В нем 85 % хлора, тогда
Пусть 15 м3 – 100 %
Х м3 – 85 %, откуда х = 85 * 15 / 100 = 12,75 м3.
Найдем массу полученного хлора
mCl = V * ρ = 12.75 * 3.24 = 41.31 кг
24,312 35,5 * 2
Составим реакцию электролиза магния MgCl2 = Mg + Cl2
у 41,31
у = 41,31 * 24,312 / (35,5 * 2) = 14,145 кг
Задача № 2. Найти количество магния, полученного электролизом на электролизере на силу тока 140 кА с выходом по току 82 % за 15 часов работы.
Решение:
Согласно первому закону Фарадея
m = I * τ * η * q, где I – сила тока, А; τ – время процесса, ч;
η – выход по току, доли единиц; q –электрохимический эквивалент, г / А*ч
q = М / z * F, где М – молярная масса;
z – число электронов, участвующих в реакции,
F – постоянная Фарадея, 26,8 А*ч
q = 24,312 / 2 * 26,8 = 0,454 г / А*ч
m = 140000 * 15 * 0,82 * 0,454 = 781788 г = 781,788 кг
Задача № 3 Определить, какое количество карналлита, содержащего 51 % MgCl2 и 49 % KCl необходимо добавить в отработанный электролит массой 18 тонн с содержанием хлорида магния 8 %. Концентрация хлорида магния в рабочем электролите должна составлять 14 %.
Решение:
у 18 т х
Рабочий электролит = отработанный эл – т + свежий карналлит
С(MgCl2) = 14 % С(MgCl2) = 8 % С(MgCl2) = 51 %
С(КCl) = 49 %
Масса хлорида магния в отработанном электролите составляет
18 т – 100 %
х т - 8 % , тогда х = 18 • 8 / 100 = 1,44 т.
Пусть х – масса свежего карналлита, который необходимо добавить к отработанному электролиту. Масса хлорида магния в нем составит 0,51 * х.
Масса рабочего электролита составит у = 18 + х
Масса хлорида магния в рабочем электролите должна составлять 0,14 * у
Тогда справедливо уравнение:
Масса MgCl2 в отработанном электролите + масса MgCl2 в свежем карналлите = масса MgCl2 в рабочем электролите, т. е.
1,44 + 0,51*х =0,14 *у, а так как у = 18 + х, то
1,44 + 0,51*х =0,14 * (18 + х)
1,44 + 0,51*х = 2.52 + 0.14*х
0.51х – 0.14х = 2,52 – 1,44
0.37х = 1,08
х = 2,92 тонны
Задача № 4 В магниевый электролизер, работающий на силе тока 100 кА и с выходом по току 81 % через каждые 9 часов заливают карналлит следующего состава: 52 % MgCl2, 48 % KCl . После заливки расплава концентрация хлорида магния составляет 15 %, отработанный электролит содержит 6 % хлорида магния. Какое количество электролита должно удаляться из ванны перед заливкой, если общий объем расплава 8 м3, плотность расплава 1,65 г/см3.
Решение:
1) Найдем общую массу расплава с учетом его объема и плотности
ρ = m / V, откуда m = ρ * V,
V = 8 м3 = 8 * (100 см)3 = 8000000 см3
m = 1,65 * 8000000 = 13200000 г = 13200 кг
Количество хлорида магния в этом электролите составляет (15 %)
mMgCl2 ЭЛ = m * 0.15 = 13200 * 0,15 = 1980 кг
2) Определим количество полученного магния и израсходованного электролита за 9 часов работы электролизера
mMg = I * q * η * τ = 100000 * 0,81 * 0,454 * 9 = 330966 г = 330,966 кг
Составим общее уравнение электролиза MgCl2 = Mg + Cl2
Молярная масса , г/моль 95,312 24,312
Масса, кг х 330,966
Тогда количество электролита х = 95,312 * 330,966 / 24,312 = 1297,509 кг
3) Если за 9 часов 1297,509 кг электролита расходуется на электролиз, количество оставшегося отработанного электролита составит
m ОТР = m - х = 13200 – 1297,509 = 11902,491 кг
В этом электролите количество хлорида магния (6 %)
mMgCl2 ОТР ЭЛ = mОТР * 0.06 = 11902,491 * 0,06 = 714,149 кг
4) Если израсходовалось 1297,509 кг электролита, необходимо добавить такое же количество карналлита. В этом карналлите количество хлорида магния (52 %) составляет
mMgCl2 КАР = mКАР * 0.52 = 1297,509 * 0,52 = 674,7 кг
5) В новом электролите после электролиза и заливки карналлита будет содержаться хлорида магния
mОТР * 0.06 + mКАР * 0.52 = 714,149 + 674,7 = 1388,849 кг
Это составит 13200 кг - 100 %
1388,849 – у
у = 1388,849 * 100 / 13200 = 10,52 %
А по условию необходимо 15 % хлорида магния, поэтому перед заливкой свежего карналлита необходимо часть отработанного электролита (z) слить, масса оставшегося электролита:
m ОТР - z = 11902,491 - z
В этом оставшемся электролите также содержится 6 % хлорида магния, поэтому его количество
∆mMgCl2 = 0.06 *( m ОТР – z) = 0.06 * (11902,491 – z)
Тогда необходимо добавлять карналлита
13200 – (11902,491 – z)
с содержанием хлорида магния 0,52 * {13200 – (11902,491 – z)}
Суммарное содержание хлорида магния в рабочем электролите должно составлять
mMgCl2 ЭЛ = 1980 кг
Составим уравнение
0.06 * (11902,491 – z) + 0,52 * {13200 – (11902,491 – z)} = 1980 кг
714,149 – 0,06 z + 0,52 * (1297.509 + z) = 1980
- 0.06 z + 0,52 z = 1980 – 714.149 – 674.705
0,46 z = 591,146
z = 1285,1 кг
Задача № 5 Определить периодичность заливки карналлита, содержащего 53 % MgCl2 , 47 % KCl, в магниевый электролизер, если после заливки расплава концентрация хлорида магния составляет 16 %, отработанный электролит содержит 5 % хлорида магния. Сила тока составляет 105 кА, выход по току 82 %. Общий объем расплава 10 м3, плотность 1,65 г/см3.
Решение
1) Масса электролита
ρ = m / V, откуда m = ρ * V,
V = 10 м3 = 10 * (100 см)3 = 10000000 см3
m = 1,65 * 10000000 = 16500000 г = 16500 кг
Количество хлорида магния в этом электролите составляет (16 %)
mMgCl2 ЭЛ = m * 0.16 = 16500 * 0,16 = 2640 кг
2) Производительность электролизера составляет
mMg = I * q * η * τ =105000 * 0,454 * 0,82 * τ = 39089,4 * τ =39,089 * τ , кг – столько получают магния между заливками.
Для получения такого количество магния необходимо хлорида магния:
MgCl2 = Mg + Cl2
Молярная масса , г/моль 95,312 24,312
Масса, кг х 39,089 * τ
Тогда х = 95,312 * 39,089 * τ / 24,312 = 153,244 * τ, кг
3) Через количество времени τ, хлорида магния останется
mMgCl2 ЭЛ – х = 2640 – 153,244 * τ, кг
По условию это составляет 5 % хлорида магния от общей массы электролита
4) Количество оставшегося электролита при условии, что расходуется только хлорид магния, составит
m – х = 16500 - 153,244 * τ, кг
Примем его за 100 %, тогда 16500 - 153,244 * τ = 100 %
2640 – 153,244 * τ = 5 %
(16500 - 153,244 * τ) * 5 = (2640 – 153,244 * τ) * 100
82500 – 766,22 * τ = 264000 – 15324,4 * τ
– 766,22 * τ + 15324,4 * τ = 264000 – 82500
14558,18 * τ = 181500
τ = 12,5 часов
Выход по току и удельный расход энергии
Данные показатели зависят от величины потерь магния и хлора в результате побочных химических реакций и электрохимических процессов, происходящих в объеме электролита и на электродах, а также от величины потерь магния со шламом и обработанным электролитом и степени уноса хлора с газами.
На выход по току влияет концентрация хлорида магния и состав электролита.
Максимального значения 90 % выход магния по току достигает при концентрации хлорида магния - 20% . Понижение выхода по току при уменьшении концентрации хлорида магния (<20%) вызвано концентрационной поляризацией ионов Мg и началом разряда ионов щелочных металлов. При концентрации хлорида магния < 3 - 4 % выход по току резко уменьшается, увеличивается удельный расход электроэнергии, а на катоде идет процесс восстановления ионов натрия и калия.
Понижение выхода по току при концентрации хлорида магния > 20 % объясняется сдвигом равновесия реакции вправо, в результате в электролите повышается концентрация одновалентных ионов магния, возрастает скорость окисления этих ионов хлором и растворенными в электролите кислородом и водой.
Оптимальная концентрация хлорида магния в электролите зависит от плотности тока, состава электролита, качества сырья, конструкции электролизера и подбирается опытным путем (на практике концентрация МgС12 не выше 15-18%).
Перед заливкой хлорида магния в ванну концентрация его в электролите должна быть не ниже 5-7 %. Для получения стабильных и высоких выходов по току необходимо осуществлять более частую загрузку сырья в электролизер, еще лучше – непрерывную. При тиком режиме питания электролизера снижается количество образующегося шлама за счет улучшения условий хлорирования оксида магния анодным хлором.
Состав электролита. В случае использования для питания электролитов возвратного хлорида магния соотношение компонентов в электролите можно изменять, добавляя их непосредственно в электролит. Введение в электролит некоторого количества хлорида бария и хлорида кальция приводит к повышению выхода по току. Концентрацию добавок и основных компонентов устанавливают с учетом влияния их на выход по току, электропроводимость, смачиваемость и др.
При питании ванны возвратным хлоридом магния температура электролиза составляет 670 - 700 0С, обезвоженным карналлитом – 700 – 720 0С. При температурах выше 720 – 730 0С увеличивается скорость окисления магния хлором и кислородом воздуха, усиливается интенсивность побочных реакций, снижается разность плотностей магния и электролита.
Расстояние между анодом и катодом (МПР). При уменьшении МПР увеличиваются потери магния за счет большого числа капель магния, попадающих в прианодное пространство и окисляющихся там хлором. Особенно сильно евлияние оказывает МПР < 6 см. На практике составляет 6 – 8 см. При МПР > 8 см влияния на электролиз не ощущается.
Высота анодов. Влияние высоты анодов (погруженной в электролит части анода) является следствием изменения интенсивности циркуляции электролита, которая зависит от количества выделяемого на аноде газа при неизменной анодной плотности тока. Количество газа, проходящего через единицу поверхности электролита в МПР прямо пропорционально высоте анода. При малой высоте анода снижается интенсивность циркуляции электролита, сила восходящего потока электролита уже не в состоянии увлечь с собой магний в катодное пространство диафрагменного электролизера. При большой высоте анодов скорость подъема электролита возрастает, в пространстве за диафрагмой не происходит полного отделения капель магния. Мелкие капли магния захватываются движущимся с большой скоростью потоком электролита и снова выносятся в межэлектродное пространство. Это приводит к тому, что часть магния оказываясь в анодном пространстве, попадает под прямое воздействие выделяющегося на аноде хлора.
Тип электролизера. Для каждого типа электролизера и состава электролита существуют свои параметры: анодная и катодная плотность тока, мсжэлектродное расстояние, высота анода, глубина ванны, высота диафрагмы и др. На выход по току влияет скорость и характер циркуляции электролита в электролизере. Особенно большое значение циркуляция электролита имеет в бездиафрагменных электролизерах. Выход по току в бездиафрагменных электролизерах ниже, чем в диафрагменных. Выход по току снижается на 5 - 6 % из-за вредного влияния примесей.
ВОПРОСЫ
1. Как влияет на выход по току концентрация хлорида магния?
2. Как влияет добавка хлоридов бария и кальция на выход по току?
3. Влияет ли температура на выход по току?
4. Как зависят выход по току от междуполюсного расстояния и почему?
5. Почему в бездиафрагменных электролизерах выход по току ниже, чем в диафрагменных?
6. Какой должна быть концентрация хлорида магния в электролите перед заливкой его в ванну?
Потери магния
Длительный контакт капель магния с хлором приводит к потерям магния. В верхнем и среднем слоях электролита в рабочих ячейках бездиафрагменных электролизеров при большой ширине анода и недостаточно интенсивном "выталкивании" верхней части электролита возникают зоны замкнутой циркуляции электролита с капельками магния. Увеличение плотности тока и использование более высоких анодов благоприятствует выносу магния в сборную ячейку.
В промышленных электролизерах потери магния составляют 15-30%. Эти потерн возникают по следующим причинам:
- взаимодействие продуктов электролиза - хлора и магния,
- окисление магния кислородом и влагой воздуха,
- разряд ионов примесей на катоде и их взаимодействие с магнием,
- потери со шламом, особенно в результате пассивации катода.
Растворимость магния в хлоридных расплавах определяется обратимой реакцией:
MgCl2 + Mg = 2MgCl
Растворимость магния в расплавленных хлоридах мало зависит от их состава, понижается с уменьшением содержания МgС12 в расплаве и не превышает 0,02% (по массе). При нормальном процессе электролиза потери магния в шламе не велики— 03 - 0,5% , если считать, что выход шлама составляет 0,1 кг на 1кг магния с содержанием 4% Мg. Содержание магния в шламе увеличивается при повышенных концентрациях примесей в электролите и при пассивации катода.
Соединения железа, марганца, титана, никеля и другие восстанавливаются на капельках магния, которые утяжеляются и оседают на подину ванны в шлам. Мелкодисперсные Мg0, Si02, Аl2O3 и другие адсорбируются капельками магния. Это также способствует их погружению на подину и попаданию в шлам.
Потери магния от окисления кислородом воздуха составляют всего 2-3 % , т. к. пленка электролита хорошо защищает поверхность металла от соприкосновения с воздухом. Но если пленка нарушается, то магний начинает интенсивно окисляться - гореть. При этом на поверхности магния образуется оксидная пленка, не защищающая металл от дальнейшего взаимодействия с воздухом. Это происходит, когда магний плохо смачивается расплавом или когда разница в плотностях магния и электролита велика.
При больших скоплениях металла защитная пленка электролита разрывается, и магний начинает гореть. Потери магния вследствие окисления могут быть существенными.
Потери магния от вышеперечисленных факторов не превышают 5-6 % и мало зависят от основных условий процесса. На практике бывают случаи, когда потери магния достигают 25-30 %. Наибольшие потери магния - от взаимодействия магния с хлором.
Потери металла при электролизе расплавленных солей происходят из-за переноса растворенного металла к аноду и окисления его анодными газами. Потери металла лимитируются скоростью переноса его от катода к аноду. Процесс переноса растворенного металла осуществляется диффузией его через прикатодный слой и конвекцией через толщу электролита. Высокая скорость циркуляции электролита вредна. Но заводская практика показывает, что определенное повышение скорости циркуляции электролита способствует уменьшению потерь металла. Это объясняется более быстрым выносом капелек магния в сборную или катодную ячейку, где металл сливается в компактную массу и изолируется от воздействия хлора. При этом следует иметь в виду, что выделение магния в сильно диспергированной форме вызывает резкое снижение выхода по току.
В электролитах с высоким поверхностным натяжением на границе с катодом магний осаждается на поверхности катода в виде сплошного слоя, при этом в расплаве отсутствует диспергированный магний и выход по току достигает высоких значений.
ВОПРОСЫ
1. Какой механизм потерь магния?
2. От чего зависит растворимость магния?
3. Как влияет циркуляция электролита на потери магния?
4. По практическим данным увеличение скорости циркуляции электролита увеличивает выход по току. Почему?
5. Как влияет поверхностное натяжение на потери магния?
6. Как влияет плотность и вязкость электролита на потери магния?
7. Чем обусловлены наибольшие потери магния?
Поведение примесей при электролизе
Примеси попадают в электролит с поступающим сырьем, в результате взаимодействия расплава с футеровкой и другими конструктивными элементами электролизера.
Присутствие примесей может быть причиной снижения выхода по току, образования больших количеств шлама, выпуска несортового металла и снижения концентрации хлора в анодных газах.
