
- •Содержание
- •1. Введение
- •2. Цели и задачи вариативного курса
- •Информационная часть
- •Система контроля качества лекарственных средств
- •Контроль качества лекарственных средств
- •Надлежащие практики в фармации
- •4. Российские нормативные документы, регламентирующие производство лекарственных средств
- •5. Государственная фармакопея рф
- •Международные и региональные сборники унифицированных требований и методов испытаний лекарственных средств
- •Испытательная лаборатория (центр) по контролю качества лекарственных средств - часть системы контроля качества лекарственных средств
- •7. Понятие об испытательной лаборатории (центре) по контролю качества лекарственных средств
- •8. Правила gpcl
- •9. Структура испытательной лаборатории (центра) по контролю качества лекарственных средств
- •10. Основные задачи испытательной лаборатории (центра) по контролю качества лекарственных средств
- •11.Функции испытательной лаборатории (центра) по контролю качества лекарственных средств
- •12. Основные положения паспорта испытательной лаборатории (центра) по контролю качества лекарственных средств
- •Общие требования к компетентности испытательной лаборатории (центра) по контролю качества лекарственных средств
- •Перечень оборудования, необходимого при проведении аккредитации на техническую компетентность испытательной лаборатории (гост р 51000.4-2008)
- •Лабораторное оборудование и приборы
- •Требования к оборудованию испытательной лаборатории
- •Метрология — наука об измерениях
- •Законодательные акты рф об обеспечении единства измерений
- •Виды весов и их поверка
- •Весы лабораторные, прецизионные
- •Аналитические электронные весы
- •Технохимические весы
- •Компараторы массы (масскомпараторы)
- •Калибровка весов
- •Средства калибровки
- •Поверка средств измерений
- •Виды поверок
- •Методика поверки
- •Точность взвешивания
- •Поверка и калибровка мерной посуды
- •Краткая характеристика химической посуды
- •Мерная посуда
- •Самостоятельная работа студентов на занятиях
- •Задание 2. Проверка вместимости пипетки
- •Практическая часть
- •Задание 3. Проверка вместимости мерной колбы
- •Практическая часть
- •Задание 4. Проверка вместимости бюретки
- •Практическая часть
- •1 Этап. Проверка полной вместимости бюретки
- •Проверка вместимости участков бюретки, отличающихся на 5 мл
- •! Сливать воду из бюретки по 5, 10,15,20,25 мл от нуля «0».
- •Лабораторная работа 2 поверка лабораторных весов wtb 200
- •Условия поверки
- •2. Подготовка к поверке
- •3. Проведение поверки
- •Контрольные вопросы по теме:
- •Контроль качества лекарственных средств.
- •Формы контроля качества л.С.
- •Надлежащие практики в фармации.
-
Контроль качества лекарственных средств
В соответствии с действующим законодательством «контроль качества лекарственных средств при их гражданском обороте проводится уполномоченными федеральными органами исполнительной власти и органами исполнительной власти субъектов Российской Федерации».
При этом практикуются следующие формы контроля:
-
Предварительный контроль при регистрации ЛС (организация проведения экспертизы качества, эффективности и безопасности ЛС, сбор и анализ информации о побочных эффектах применения ЛС).
-
Выборочный контроль проводится на основании планов выборочного контроля качества Росздравнадзора, формируемого по результатам сбора и анализа информации о качестве ЛС.
-
Повторный выборочный контроль при выявлении несоответствия лицензионным требованиям и условиям производства и внутризаводского контроля качества продукции, несоблюдения правил оптовой и розничной торговли лекарственными препаратами, правил хранения.
При государственной регистрации заявленные лекарственные средства проходят тщательную экспертизу с целью обеспечения гарантии соответствия современным требованиям безопасности, качества и эффективности. Но этим дело не ограничивается. Для того чтобы зарегистрированные препараты могли производиться, владелец регистрационного удостоверения должен получить соответствующую лицензию на промышленный выпуск данного лекарственного средства и строго соблюдать лицензионные условия. То же самое касается дистрибуции, реализации, хранения и уничтожения лекарственных средств.
В последнее время в регистрационную систему были внесены значительные изменения в направлении ее сближения с международной практикой и сокращения различий в отношении отечественных и зарубежных препаратов (Административный регламент Росздравнадзора по регистрации лекарственных средств, 2006).
В 2005 г. в целях совершенствования системы контроля качества в его структуре организовано Федеральное государственное учреждение «Научный центр экспертизы средств медицинского применения» (НЦЭСМП) Росздравнадзора» с 15 филиалами в субъектах РФ, осуществляющее экспертизу ЛП.
Государственный контроль начинается задолго до регистрации лекарственного препарата как такового. Другими словами, он начинается практически уже на этапе научных разработок, т.е. лабораторных, доклинических и клинических испытаний.
-
Надлежащие практики в фармации
Работники фармацевтической отрасли, задействованные на всех этапах жизненного пути препарата (рис. 1), от разработки до уничтожения, призваны соблюдать правила и другие нормативные документы, которые составляют нормативно-правовую базу. Эта база находится в состоянии модернизации и совершенствования. Более того, грядущая интеграция России в ВТО диктует необходимость гармонизации отечественной нормативно-правовой базы с международной практикой обращения лекарственных средств.
Уже сейчас в фармации активно внедряются надлежащие практики (правила), которые, исходя из сокращений, можно объединить в одну формулу GxP,
где х – различные сферы применения практики (правил).
Это – надлежащие:
лабораторная практика (GLP)
клиническая практика (GCP)
производственная практика (GMP)
практика хранения (GSP)
практика дистрибуции (GDP)
аптечная практика (GPP)
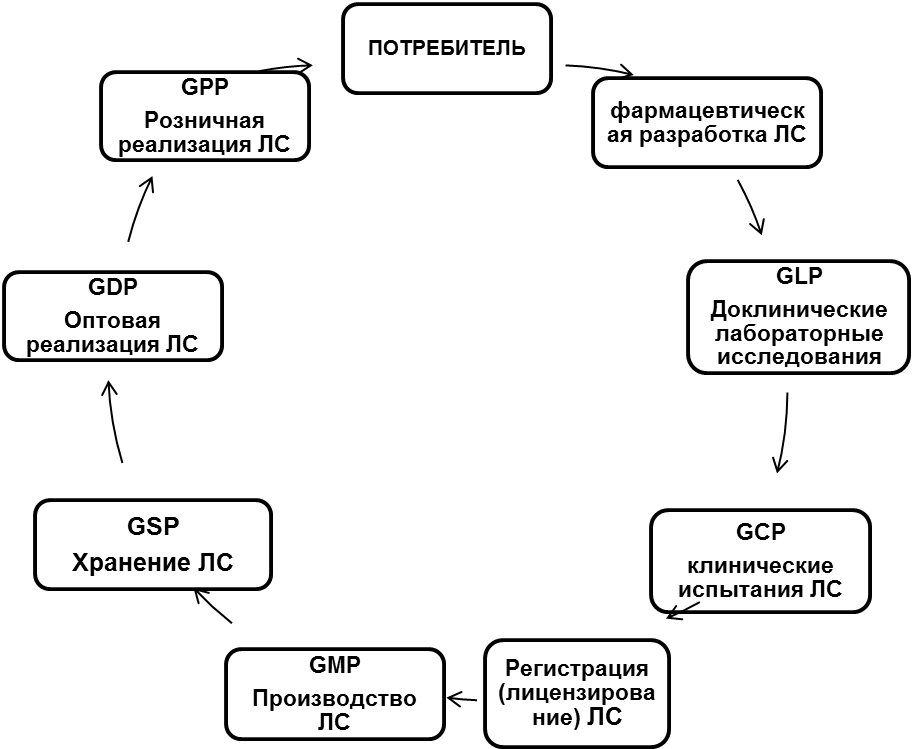
Рис. 1. Этапы жизненного цикла ЛС
Согласно современным представлениям «на каждом этапе разработки, изготовления и распределения лекарственных средств принимаются специфические для этого этапа меры по недопущению ошибок и отклонений в работе, которые могут отрицательно повлиять на качество.
Таким образом, взаимосвязь перечисленных стандартов GxP составляет систему обеспечения качества лекарственных средств, охватывающую весь жизненный цикл препарата.
На фармацевтический рынок РФ поступают лекарственные средства, произведенные как в условиях соблюдения международных стандартов GMP, так и лекарственные средства из развивающихся стран, в которых предприятия работают по национальным стандартам. Как правило, препараты из стран СНГ выпускаются на предприятиях, не аттестованных на соответствие GMP.
В РФ из 400 производителей лекарственных средств только 30 располагают производственными площадками, соответствующими международным правилам надлежащей производственной практики (Голикова Г.А., 2010). ФЗ «Об обращении лекарственных средств» установлен срок перехода отечественных производителей на требования GMP - начало 2014 г.
3. Правила GLP
GLP (Good Laboratory Practice) – качественная лабораторная практика. Это стандарты, на основании которых осуществляется планирование, проведение доклинических исследований, составление протоколов и оформление отчетов исследований. Важнейшее место в правилах GLP отводится контролю за проведением испытаний и требованиям к вивариям и качеству животных. Соблюдение правил GLP позволяет обеспечивать достоверность результатов исследований и их воспроизводимость.
Концепция GLP зародилась в США в 1970-е годы, когда сотрудники FDA (Администрации по пищевым и лекарственным продуктам Департамента здравоохранения США), не удовлетворенные качеством выполнения и обработки результатов экспериментальных исследований, начали разработку ее основных принципов. Впервые Правила СLР были сформулированы в США в 1976 г. и вступили и силу с 1979 г.
Правила GLP включают в себя:
- требования к организации испытаний;
- требования к личному составу исследователей;
- требования к помещениям, в которых проводятся испытания и содержатся животные;
- требования к качеству животных, к условиям их содержания и кормления;
-требования к лабораторному оборудованию и к его калибровке;
- требования к испытуемому и контрольному веществу;
-требования к составлению и проведению подробной стандартной методики экспериментальных работ (SOP – standard operating procedure) и к порядку проведения испытаний (протокол);
- требования к регистрации данных и оформлению отчета;
- требования к службе контроля за качеством испытаний;
- стандартные методики экспериментальных работ.
Правила GLP, впервые разработанные в США, очень быстро получили признание в других странах мира. Практически все развитые страны в настоящее время регламентируют создание, испытания и производство препаратов своими национальными правилами и нормами, в основе которых лежат требования GLP.
