
ДЗ2 аналит
.docxМосковский технологический университет
Институт тонких химических технологий
Кафедра аналитической химии имени И.П.Алимарина
Домашнее задание №2
Проверка критерия осуществимости комплексонометрического титрования металла в присутствии постороннего лиганда
Группа ХББО-01-16
Студентка Иванова Е.А
Преподаватель: Романовская Л.Е.
Москва 2017
Вариант 9
ДАНО:
Men+ ≡ Zn2+
cº(Zn2+) = 0,10 моль/л
L ≡ S2O32-
cº(S2O32-) = 0,5 моль/л
T ≡ Na2H2Y*2H2O
Δr = 1%
pH = 8
Константы устойчивости Zn2+ с L:
K1 = 1,95*102 ;
K2 = 2,00*102
РЕШЕНИЕ:
-
Происходит титрование раствора, содержащего катионы Zn2+, трилоном Б в присутствии посторонних лигандов S2O32-, к которым могут присоединяться катионы цинка Zn2+.
Основная реакция:
При рН = 8 в растворе трилона Б превалируют частицы HY3-:
Zn2+ + HY3- ⇄ ZnY2- + H+
X T P
Константа
равновесия:
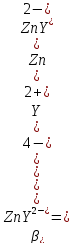 = 1,82*1016
= 1,82*1016
-
Одновременно происходят побочные реакции:
Zn2+
+ OH-
⇄
ZnOH+ 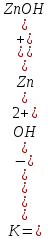
ZnOH+
+ OH-
⇄
Zn(OH)2 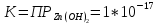
Zn2+
+
S2O32-
⇄
ZnS2O3 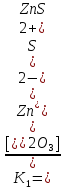 = 1,95*102
= 1,95*102
ZnS2O3
+
S2O32-
⇄
[Zn(S2O3)2]2- 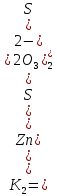 = 2,00*102
= 2,00*102
-
Значение константы равновесия
 получено без учета конкурирующих
реакций. Необходимо рассчитать условную
константу равновесия, учитывающую
реальные равновесия в системе:
получено без учета конкурирующих
реакций. Необходимо рассчитать условную
константу равновесия, учитывающую
реальные равновесия в системе:
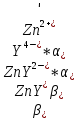 ,
,
где
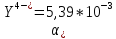 – мольная доля непротонированной формы
ЭДТА для рН = 8
– мольная доля непротонированной формы
ЭДТА для рН = 8
Для расчета мольной доли катионов цинка, связанных с посторонними лигандами, выразим равновесную концентрацию лиганда через исходные концентрации металла, лиганда и среднее лигандное число и найдем численное значение:
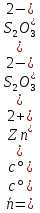 ⇒
⇒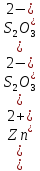
-
Мольная доля цинка рассчитывается по формуле:
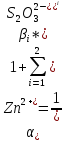 ,
где
,
где

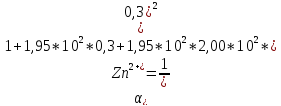
-
Отсюда значение условной константы равновесия равно:
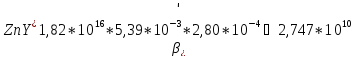
-
Проверка осуществимости титрования:
Для реакций вида X+T⇄P критерий осуществимости титрования представлен формулой:
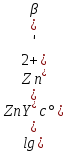

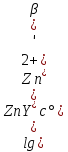
Вывод: комплексонометрическое титрование цинка при рН=8 в присутствии постороннего лиганда S2O32- с погрешностью, не превышающей 1%, возможно.
