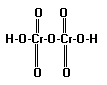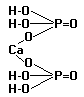- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
4.3. Составление структурных формул молекул.
4.3.1.Структурные формулы оксидов:
|
Al2O3 |
|
Na2O |
|
|
|
|
|
|
|
|
Mn2O7 |
|
|
4.3.2.Структурные формулы кислот строятся таким образом, что атом водорода соединяется с атомом неметалла через кислород: например,
|
H2CO3 |
H2Cr2O7 |
|
|
|
|
|
|
4.3.3.Структурные формулы оснований:
 4.3.4.Структурные
формулы солей
4.3.4.Структурные
формулы солей
|
|
|
|
|
|
4.4.Ионная связь и ее свойства
Ионная связь объясняется следующим образом: атом - типичный металл - теряет свой валентный электрон, превращаясь в катион. Атом – типичный неметалл - принимает электрон, превращаясь в анион.
Na0
–
![]() =
Na+
(катион)
Cl0
+
=
Na+
(катион)
Cl0
+
![]() =
Cl--
(анион)
=
Cl--
(анион)
Ионная связь является максимально полярной. Она образуется атомами тех элементов, которые имеют максимально различные электроотрицательности, т. е. ионная связь образуется щелочными и щелочно-земельными металлами и галогенами:KF; CaCl2; NaI. Ионная связь имеет два основных свойства:
-
ненаправленность,
-
ненасыщаемость.
Эти два свойства тесно связанны между собой. Два иона: катион и анион полностью не могут компенсировать силовые поля друг друга, поэтому для компенсации своих зарядов каждый ион вынуждает притягивать из пространства дополнительные ионы противоположного знака. В этом заключается ненасыщаемость. Так как электрическое поле иона имеет сферический характер, то для ионной связи характерна ненаправленность. Благодаря тому, что энергия ионизации больше энергии сродства к электрону, полного перехода электронов не происходит даже в случае атомов с очень большой разностью электроотрицательности. Таким образом, соединений с чисто ионной связью не существует. Можно говорить лишь о доле ионной связи. В силу особенностей ионной связи, т.е. её полярности, ненаправленности и ненасыщаемости, молекулы с ионной связью являются достаточно относительным понятием. В водных растворах и расплавах ионные молекулы полностью диссоциированы на ионы: AB=A++B-. Двух- и трёхионных соединений не существует, а весь кристалл ионного соединения можно рассматривать как молекулу, состоящую из огромного числа ионов:АmBn .
4.5. Водородная связь и ее свойства.
Атом водорода – самый маленький и самый легкий из всех существующий атомов. Имеет заряд +1. С наиболее электроотрицательными элементами (F, О, N) водород образует дополнительные связи, которые называют водородными. Водородная связь возникает между водородом и кислородом, которые принадлежат к различным молекулам и ковалентно между собой не связаны. Водородную связьобозначают точками.
 Водородная
связь близка к межмолекулярным связям.
Все межмолекулярные связи имеют низкую
энергию. Энергия водородной связи
низкая: 8 ÷ 40 кДж/моль. Наиболее высокая
энергия водородной связи у водорода с
фтором (25÷ 40 кДж/моль), ниже - с О (13÷ 29
кДж/моль) и еще ниже с N (8 ÷ 21 кДж/моль).
Водородная связь характерна для спиртов,
карбоновых кислот, в том числе высших
и нуклеиновых, белков, поэтому, несмотря
на низкую энергию связи, водородная
связь крайне важна для жизни на Земле.
Комплементарность - пространственная
взаимодополняемость молекул или их
частей, приводящая к образованию
водородных связей. Комплементарность
лежит в основе ферментативного
катализа, самосборки биологических
структур, матричного синтеза
полинуклеотидов, молекулярных механизмов
иммунитета. Например, в строении
нуклеиновых кислот две полинуклеотидные
цепи в результате комплементарного
взаимодействия пар пуриновых и
пиримидиновых оснований (А-Т, Г-Ц)
образуют двуспиральную молекулу.
Водородная
связь близка к межмолекулярным связям.
Все межмолекулярные связи имеют низкую
энергию. Энергия водородной связи
низкая: 8 ÷ 40 кДж/моль. Наиболее высокая
энергия водородной связи у водорода с
фтором (25÷ 40 кДж/моль), ниже - с О (13÷ 29
кДж/моль) и еще ниже с N (8 ÷ 21 кДж/моль).
Водородная связь характерна для спиртов,
карбоновых кислот, в том числе высших
и нуклеиновых, белков, поэтому, несмотря
на низкую энергию связи, водородная
связь крайне важна для жизни на Земле.
Комплементарность - пространственная
взаимодополняемость молекул или их
частей, приводящая к образованию
водородных связей. Комплементарность
лежит в основе ферментативного
катализа, самосборки биологических
структур, матричного синтеза
полинуклеотидов, молекулярных механизмов
иммунитета. Например, в строении
нуклеиновых кислот две полинуклеотидные
цепи в результате комплементарного
взаимодействия пар пуриновых и
пиримидиновых оснований (А-Т, Г-Ц)
образуют двуспиральную молекулу.
4.6.Металлическая
связь и ее свойства.
 4.7Упражнения
для самоконтроля направлены на закрепление
следующих понятий:
4.7Упражнения
для самоконтроля направлены на закрепление
следующих понятий: