
- •Законы, определяющие положение электронов в атоме
- •Электронное строение атома. Закономерности изменения свойств элементов и их соединений.
- •Группы периодической таблицы
- •Периодичность изменения свойств элементов.
- •Химическая связь и межмолекулярные взаимодействия.
- •Элементы химической термодинамики.
- •Химическая кинетика. Химическое равновесие. Катализ.
- •Растворы. Электрохимические процессы.
- •Химия элементов I- III групп и их соединений.
- •Химия элементов V-VII групп и их соединений
- •Элементы группы углерода.
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
Национальный исследовательский ядерный университет «МИФИ»
Волгодонский инженерно-технический институт – филиал НИЯУ МИФИ
Конспект лекций
по курсу «Химия»
для всех специальностей
составил к.х.н., доцент Сапельников В.М.
Волгодонск 2011 г.
ЛЕКЦИЯ 1
Введение. Основные химические законы. Квантовомеханическая модель атома.
Атом - это мельчайшая, химически неделимая электронейтральная частица вещества. В центре атома находится ядро, состоящее из протонов p и нейтронов n. Вокруг ядра вращаются электроны ē. Разновидности атомов одного и того же элемента, отличающиеся своей массой, называются изотопами. Атомы, ядра которых имеют различные заряды, но одинаковую массу, называют изобарами.
Количество элементарных частиц (протонов p, электронов ē и нейтронов n) можно определить по формулам:
p= ē =Z;
n =А-Z,
где Z — порядковый номер элемента; А – атомная масса изотопа элемента.
Любые изотопы, в том числе и стабильные, можно превратить в изотопы
других элементов путем бомбардировки их ядер тяжелыми элементарными
частицами (протонами, нейтронами), либо ядрами легких элементов (гелия, лития, кислорода и др.). При этом одновременно с дочерним ядром образуется одна или несколько элементарных частиц.
Процессы взаимодействия ядер одних элементов с ядрами других элементов или с элементарными частицами, при которых образуются ядра новых элементов, получили название ядерных реакций. При составлении уравнений ядерных реакций необходимо учитывать закон сохранения массы веществ (масса электронов при этом не учитывается). Кроме того, заряды всех частиц в левой и правой частях уравнения должны быть равны. Подобно химическим, ядерные реакции подразделяются на реакции обмена, присоединения, разложения (радиоактивный распад).
Для характеристики энергетического состояния электрона в атоме квантовая механика пользуется системой четырех квантовых чисел:
1. Главное квантовое число n характеризует энергетический уровень, на котором находится электрон, а следовательно, общий запас его энергии. Число n принимает целочисленные значение от 1 до ∞, а для атомов элементов в нормальном, невозбужденном состоянии — от 1 до 7. Уровни, отвечающие этим значениям, обозначаются соответственно буквами К, L. М, N, О, Р и Q.
2. Энергетические состояния электронов одного уровня могут несколько отличаться друг от друга в зависимости от конфигураций их электронных облаков, образуя группы электронов разных подуровней. Для характеристики подуровня служит побочное, или орбитальное, квантовое число ℓ, которое может иметь целочисленные значения в пределах от 0 до n - 1. Так, если главное квантовое число n = 1, то побочное квантовое число имеет только одно значение (ℓ =0), а при этом значении n понятия уровень и подуровень совпадают. При n =4 величина ℓ принимает четыре значения, а именно: 0, 1, 2, 3. Электроны, отвечающие этим значениям называются соответственно s-, p-, d- и f-электронами.
Электроны различных подуровней отличаются формой электронных облаков. Для s-электронов характерна простейшая форма - сфера; для p-электронов — форма вытянутых восьмерок, или гантелей, оси которых располагаются по отношению друг к другу под углом 90° и обозначаются px, pу и pz. Формы облаков d- и особенно f-электронов гораздо более сложные.
3. Магнитное квантовое число mℓ характеризует расположение плоскости электронной оpбитали, т.е. ее наклон относительно магнитной оси атома. Если побочное квантовое число равно ℓ то проекция орбитального момента электрона на магнитную ось атома принимает целочисленные значения от - ℓ до + ℓ, а всегo 2 ℓ + 1 значений. Так, если ℓ =0, то mℓ имеет одно значение — mℓ =0,
а при ℓ =3 оно принимает 7 значений, а именно: —3, —2, —1, 0, 1, 2, 3.
4. Для электрона характерно также вращение вокруг собственной оси, которое может происходить в двух взаимно противоположных направлениях. Возникающие при этом собственные магнитные моменты электрона имеют два значения в зависимости от того, совпадают они с ориентацией орбитального момента электрона или направлены в противоположную сторону. В связи с этим спиновое квантовое число ms, может иметь значение +1/2 или —1/2.
Законы, определяющие положение электронов в атоме
1.Любая частица стремится к минимальному запасу потенциальной энергии.
2. Запрет Паули. В атоме не может быть двух электронов, имеющих одинаковые значения всех четырёх квантовых чисел. Запрет Паули определяет электронную ёмкость орбиталей, подуровней и уровней. Электронная ёмкость уровней рассчитывается по формуле: N = 2n2, где N – число электронов на данном уровне, n – главное квантовое число.
3. Принцип Хунда. На данном энергетическом подуровне электроны располагаются таким образом, чтобы модуль их суммарного спина был максимальным.
4. Первый закон Клечковского. Электронами в первую очередь заполняются орбитали с меньшим значением суммы главного и орбитального чисел, а затем уже орбитали с большим значением суммы этих двух чисел. Согласно первому закону Клечковского, в первую очередь заполняются электронами ns-орбитали, а затем (n-1)d, которые имеют больший запас потенциальной энергии.
5. Второй закон Клечковского. Если две орбитали имеют одинаковое значение суммы главного и орбитального чисел, то в первую очередь электронами заполняется та орбиталь, у которой главное квантовое число имеет меньшее значение.
6. Порядок заполнения атомных орбиталей.
Заполнение электронами энергетических уровней и подуровней происходит в соответствии с принципом минимальной энергии, правилами Гунда и Клечковского:
![]()
![]()
ЛЕКЦИЯ 2
Электронное строение атома. Закономерности изменения свойств элементов и их соединений.
Система четырех квантовых чисел позволяет определить число возможных состояний электрона в атоме в зависимости от уровня и подуровня, на котором он находится.
Согласно принципа (запрета) Паули в атоме не может быть двух и более электронов с четырьмя одинаковыми квантовыми числами.
Электроны, имеющие одинаковые значения n, ℓ и mℓ отличающиеся спиновым квантовым числом ms, образуют орбиталь, которая условно обозначается символом . Орбиталь—это область пространства, в которой пребывание электрона является наиболее вероятным, а следовательно, электронное облако отличается максимальной плотностью.
Правило Гунда заключается в том, что при заполнении орбиталей с одинаковой энергией электроны располагаются так, чтобы суммарный спин их был максимальным.
При переходе от одного элемента к следующему в периодической системе электрон стремится занять состояние с минимальной энергией. Последовательность заполнения электронами энергетических уровней и подуровней в порядке возрастания их энергии подчиняется правилу М. В. Клечковского и имеет
следующий вид:
1s < 2s < 2p < зs < Зp < 4s < 3d< 4р < 5s < 4d< 5р < 6s < 5d (или 4f ) <6p
Атом не имеет строго определенных границ. За его радиус принимается расстояние от ядра до главного максимума плотности внешних электронных оболочек. С увеличением заряда ядра в периодах атомный радиус немонотонно уменьшается, а в группах увеличивается.
Энергия ионизации Еi — это энергия, необходимая для отрыва наиболее
слабо связанного электрона от атома, количественно выражается в кДж/моль
или эВ. Чем меньше энергия ионизации, тем легче атом отдает электрон при
образовании химической связи, т.е. элемент является более сильным восстановителем. Поэтому восстановительная способность нейтральных атомов с ростом заряда ядра в периоде уменьшается, а в главных подгруппах растет.
Энергия сродства к электрону Еср — энергия, выделяющаяся при присоединении электрона к нейтральному атому, количественно выражается в кДж/моль или эВ. Она определяет окислительные свойства несвязанных атомов. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2, s2p6. У остальных элементов в таблице Д.И. Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
Электроотрицательностью элемента (ЭО) называют меру относительной
способности атомов оттягивать на себя электроны при образовании химической связи. Она пропорциональна как энергии ионизации, так и энергии сродства к электрону. С ростом заряда в периодах электроотрицательность в общем растет, а в подгруппах уменьшается.
Периоды. Таблица состоит из 7 периодов. Первые три периода малые, последние четыре периода большие. Физический смысл номера периода заключается в том, что номер периода соответствует главному квантовому числу или количеству электронных уровней у всех элементов данного периода.
Ёмкость первого энергетического уровня равна двум электронам (N=2), следовательно, первый период состоит из двух элементов:
|
|
S-элементами называют элемен- ты, у которых заполняются электронами S-подуровни. |
Ёмкость второго энергетического уровня N = 8. Длина второго периода составляет 8 элементов.
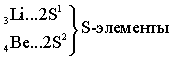
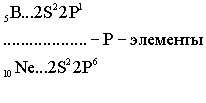 В
силу первого закона Клечковского длина
и строение третьего периода в точности
повторяют второй: два s
- элемента, шесть p
- элементов. Каждый период начинается
с двух s
– элементов, которые, за исключением
водорода и гелия, являются самыми
активными металлами. Каждый период
заканчивается активными неметаллами,
за исключением благородных газов -
химически инертых веществ.
В
силу первого закона Клечковского длина
и строение третьего периода в точности
повторяют второй: два s
- элемента, шесть p
- элементов. Каждый период начинается
с двух s
– элементов, которые, за исключением
водорода и гелия, являются самыми
активными металлами. Каждый период
заканчивается активными неметаллами,
за исключением благородных газов -
химически инертых веществ.
Четвёртый период – первый большой период (18 элементов)
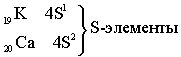

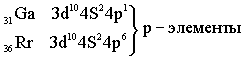
Пятый период. Длина и строение пятого периода в точности повторяет длину и строение четвёртого периода.
Шестой период. Лантан принимает первый электрон на подуровень 5d, затем, в соответствии со вторым законом Клечковского, заполнение электронами подуровня 5d приостанавливается, и начинает заполнятся электронами подуровень 4f.
|
58Сe |
4S1 5S2 5p6 5d1 6S2 |
|
|
71Lu |
4f14 5S2 5p6 5d1 6S2 |
|
|
72Hf |
5d2 6S2 |
После заполнения электронами подуровня 4f продолжается заполнение подуровня 5d, снова появляются d-элементы. |
|
80Hg |
5d10 6S2 |
Заканчивается период шестью p-элементами. Таким образом, 6-й период имеет следующее строение: s – элементы – 2, d – элементы – 1, f – элементы – 14,d – элементы – 9, p – элементы – 6 / Всего 32 элемента. Седьмой период в точности повторяет длину и строение шестого периода. Все трансурановые элементы, начиная с 93Np, являются искусственными. В больших периодах характер изменения свойств элементов тот же, что и в малых, только замедленный. Все s – элементы, кроме Н и Не, - самые активные металлы. Все d и f – элементы тоже металлы, p – элементы частично металлы, частично неметаллы.

