
- •Содержание курса химии:
- •Основные понятия и законы химии.
- •Для простых веществ:
- •Масса эквивалента соли
- •Закон Авогадро.
- •Строение вещества.
- •Модель атома вещества по Бору.
- •Квантово механическая модель атома.
- •Основной принцип квантовой механики.
- •Квантовые числа.
- •Распределение электронов в атоме по энергетическим состояниям.
- •Принцип Паули.
- •Энергия ионизации, сродство к электрону и Электроотрицательность.
- •Строение молекул. Химическая связь.
- •Природа и свойства ковалентной связи на примере строения молекул (h2, hCl, h2o).
- •Свойства ковалентной связи:
- •Ионная связь.
- •Влияние природы химической связи на свойства веществ.
- •Металлическая связь, сходство и различие между металлической и ковалентной связями.
- •Основные закономерности протекания химических реакций. Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
- •Основные понятия и законы в термодинамике.
- •Стандартное состояние.
- •Термохимические законы и расчёты по ним:
- •Закон Гесса.
- •2. Закон Лавуазье-Лапласа.
- •Направленность химических реакций.
- •Кинетика химических реакций. Основные понятия химической кинетики.
- •Скорость реакции.
- •Смещение равновесий.
- •Особенности кинетики гетерогенных реакций.
- •Дисперсные системы.
- •Растворы.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Кислоты, основания, соли с точки зрения теории электрической диссоциации.
- •Слабые электролиты.
- •Ионное произведение воды. Водородный показатель.
- •Гидролиз солей.
- •Окислительно-восстановительные реакции.
- •Электрохимия.
- •Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Химические источники тока.
- •Стаканчиковый
- •Аккумуляторы.
- •Ряд напряжений металлов.
- •Измерение электродных потенциалов. Ряд стандартных электродных потенциалов, водородный электрод.
- •Электролиз расплавов и растворов электролитов.
- •Явление поляризации при электролизе. Природа этого явления.
- •Последовательность разрядки ионов при электролизе на катоде.
- •Электролиз водных растворов электролитов.
- •Законы Фарадея.
- •Коррозия металла.
- •Защита металлов от коррозии.
Основные закономерности протекания химических реакций. Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
Химическая
реакция
– это процесс
в ходе, которого из одних веществ
образуются другие.![]()
![]() аА+bB=cC+dD
,где
аА+bB=cC+dD
,где
![]() А,
В – формулы исходных веществ,
А,
В – формулы исходных веществ,
![]() C,
D
– формулы продуктов реакции,
C,
D
– формулы продуктов реакции,
![]() a,
b,
c,
d
– стехиометрические коэффициенты в
уравнении реакций, подобранные в
соответствии с законом сохранения масс
реагирующих веществ (она отражает
количество реагирующих веществ).
a,
b,
c,
d
– стехиометрические коэффициенты в
уравнении реакций, подобранные в
соответствии с законом сохранения масс
реагирующих веществ (она отражает
количество реагирующих веществ).
В ходе химических реакций происходит разрушение одних химических связей и образование других. На разрыв связи расходуется энергия, а при образовании – выделяется. В связи с этим любая химическая реакция сопровождается энергетическим эффектом. Т.е. выделением или поглощением энергии. Эта энергия может быть затрачена или получена в различных видах:
-
тепловой;
-
электрический;
-
световой (электромагнитное излучение).
Задачами термохимической динамики являются:
-
определение физических эффектов химических реакций, в частности тепловых;
-
изменение свободной энергии системы с целью оценки возможности протекания данной реакции при данных условиях.
Основные понятия и законы в термодинамике.
Система – произвольно выбранная совокупность тел , находящаяся во взаимодействии. Основное свойство, которой является результат взаимодействия образующих ее частей.
Изолированная система – система, не обменивающаяся со средой ни веществом, ни энергией. Закрытая система обменивается со средой энергией, но не обменивается веществом. Если закрытая система получает энергию, она положительна, если отдает – отрицательна. Открытая система обменивается со средой веществом и энергией. Закрытые и изолированные системы создаются человеком с определенными целями. Химические реакции, как правило проводят в закрытых системах. Состояние системы характеризуется параметрами состояния: давления, температуры, объема и компонентный состав, т.е. какие вещества и в каком количестве в системе присутствуют.
Внутренняя
энергия системы (U)
– это общий запас энергии системы,
включающий энергию поступательного и
вращательного движения молекулы, энергию
внутримолекулярных колебаний атома,
энергию движения электронов в атоме,
внутриядерную энергию, т. е. все виды
энергии кроме кинетической энергии
движения системы как целого и его
потенциальной энергии. Внутренняя
энергия является функцией состояния
системы, U(P,V,T,![]() ).
Можно охарактеризовать состояние
системы параметрами (P1,V1,T1,
).
Можно охарактеризовать состояние
системы параметрами (P1,V1,T1,![]() ).
).
Процесс
в ходе которого меняется хотя бы один
из параметров называется термодинамическим
процессом.
И в ходе такого процесса изменяться
внутренняя энергия системы P2,V1,T1,![]() .
.
![]()
Изменение внутренней энергии не зависит от пути перехода системы из первого состояния во второе, а зависит только от начального (U1) и конечного (U2) значения внутренней энергии. Если закрытая система переходит из состояния 1 в состояние 2, она обменивается с внешней средой теплотой и механической энергией, затрачиваемой механической работой.
Закон сохранения энергии: теплота, подводимая к системе, затрачивается на изменение внутренней энергии и совершение работы, где работа, действующая против всех сил действующих на систему.
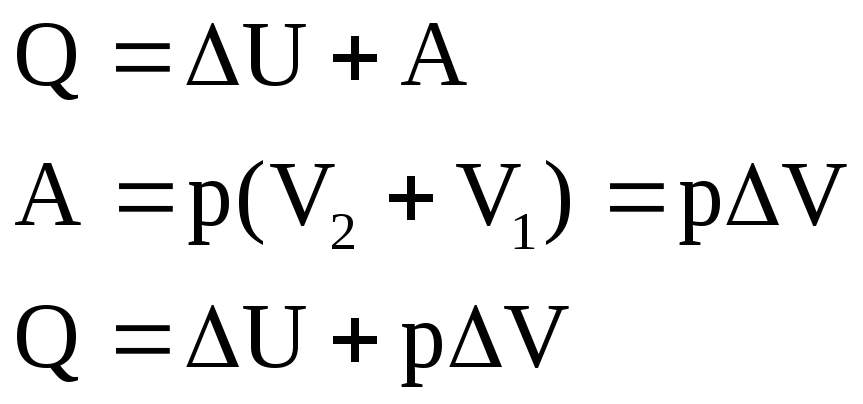
Тепловые эффекты химических реакций.
Если
в закрытой термодинамической системе
протекает химическая реакция
![]() , то в начальном состоянии у нас имеется
а моль и b
моль вещества A,
B,
что соответствует закону внутренней
энергии U
, то в начальном состоянии у нас имеется
а моль и b
моль вещества A,
B,
что соответствует закону внутренней
энергии U![]() ,
при P,
T=const;
в конечном состоянии в системе при
данных T
и P
присутствует c,
d
моль веществ C
и D
– это соответствует запасу внутренней
энергии U
,
при P,
T=const;
в конечном состоянии в системе при
данных T
и P
присутствует c,
d
моль веществ C
и D
– это соответствует запасу внутренней
энергии U![]() ,
при P,
T=const.
Тепловой эффект реакции при температуре
Т – это тепловая энергия Q,
которая выделяется или поглощается при
взаимной исходности веществ, причем
реагенты и продукты реакций находятся
при одной и той же температуре.
,
при P,
T=const.
Тепловой эффект реакции при температуре
Т – это тепловая энергия Q,
которая выделяется или поглощается при
взаимной исходности веществ, причем
реагенты и продукты реакций находятся
при одной и той же температуре.
Тепловые эффекты реакции при постоянном объеме (Qv)
V=V2=const;
![]() V=0,
то Qv=
V=0,
то Qv=![]() ;
;
Если
![]() ,
то Qv>0
,
то Qv>0
![]() тепло поглощается (эндотермическая
реакция).
тепло поглощается (эндотермическая
реакция).
Если
![]() ,
то Qv<0
,
то Qv<0
![]() тело выделяется (экзотермическая
реакция).
тело выделяется (экзотермическая
реакция).
Рекации при V=const могут идти в следующих случаях:
-
в закрытом сосуде (тепловая бомба);
-
между твердыми телами и жидкостями без выделения газа;
-
между газами, если число молекул остается постоянным.
Реакции при P=const (тепловой эффект Qp):
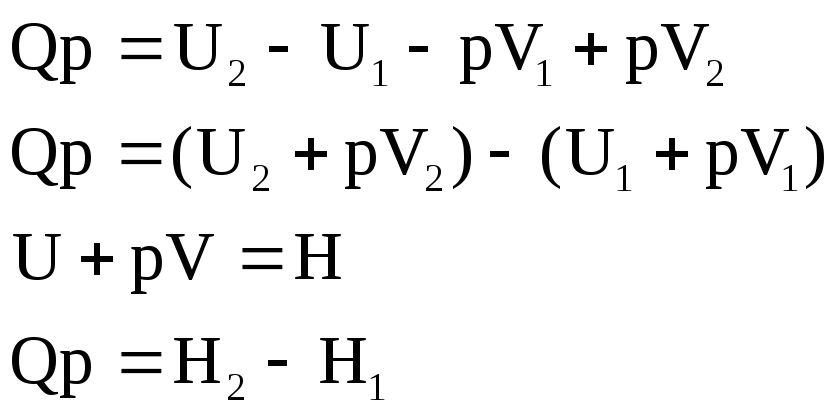
![]() -
энтальпия теплосодержания системы –
это сумма внутренней энергии и произведения
объема системы на внешнее давление.
-
энтальпия теплосодержания системы –
это сумма внутренней энергии и произведения
объема системы на внешнее давление.
![]() -
изменение энтальпии (изменение
внутреннего содержания системы).
-
изменение энтальпии (изменение
внутреннего содержания системы).
Сумма
внутренней энергии и произведение
объёма на внешнее давление называется
энтальпией (![]() ),
имеет размерность энергии и обозначается
теплосодержанием системы. Энтальпия,
как и внутренняя энергия, является
функцией состояния. Её внутреннее
значение
),
имеет размерность энергии и обозначается
теплосодержанием системы. Энтальпия,
как и внутренняя энергия, является
функцией состояния. Её внутреннее
значение
![]() неизвестно,
поэтому практическое значение имеет
неизвестно,
поэтому практическое значение имеет
![]() (изменение
энтальпии) в ходе термодинамического
процесса или входе химической реакции.
(изменение
энтальпии) в ходе термодинамического
процесса или входе химической реакции.

