
- •Содержание курса химии:
- •Основные понятия и законы химии.
- •Для простых веществ:
- •Масса эквивалента соли
- •Закон Авогадро.
- •Строение вещества.
- •Модель атома вещества по Бору.
- •Квантово механическая модель атома.
- •Основной принцип квантовой механики.
- •Квантовые числа.
- •Распределение электронов в атоме по энергетическим состояниям.
- •Принцип Паули.
- •Энергия ионизации, сродство к электрону и Электроотрицательность.
- •Строение молекул. Химическая связь.
- •Природа и свойства ковалентной связи на примере строения молекул (h2, hCl, h2o).
- •Свойства ковалентной связи:
- •Ионная связь.
- •Влияние природы химической связи на свойства веществ.
- •Металлическая связь, сходство и различие между металлической и ковалентной связями.
- •Основные закономерности протекания химических реакций. Энергетические эффекты химических реакций. Внутренняя энергия и энтальпия. Стандартная энтальпия образования вещества.
- •Основные понятия и законы в термодинамике.
- •Стандартное состояние.
- •Термохимические законы и расчёты по ним:
- •Закон Гесса.
- •2. Закон Лавуазье-Лапласа.
- •Направленность химических реакций.
- •Кинетика химических реакций. Основные понятия химической кинетики.
- •Скорость реакции.
- •Смещение равновесий.
- •Особенности кинетики гетерогенных реакций.
- •Дисперсные системы.
- •Растворы.
- •Законы Рауля.
- •Энергетические эффекты при растворении.
- •Электролитическая диссоциация.
- •На практике оказывается, что
- •Электролитическая диссоциация. Степень диссоциации - отношение числа молекул распавшихся на ионы (n) к общему числу растворенных молекул (n).
- •Сильные электролиты.
- •Кислоты, основания, соли с точки зрения теории электрической диссоциации.
- •Слабые электролиты.
- •Ионное произведение воды. Водородный показатель.
- •Гидролиз солей.
- •Окислительно-восстановительные реакции.
- •Электрохимия.
- •Возникновение скачка потенциала на границе электрод-электролит.
- •Гальванические элементы.
- •Химические источники тока.
- •Стаканчиковый
- •Аккумуляторы.
- •Ряд напряжений металлов.
- •Измерение электродных потенциалов. Ряд стандартных электродных потенциалов, водородный электрод.
- •Электролиз расплавов и растворов электролитов.
- •Явление поляризации при электролизе. Природа этого явления.
- •Последовательность разрядки ионов при электролизе на катоде.
- •Электролиз водных растворов электролитов.
- •Законы Фарадея.
- •Коррозия металла.
- •Защита металлов от коррозии.
Кинетика химических реакций. Основные понятия химической кинетики.
Термодинамический расчет позволяет сделать вывод о возможности той или мной реакции и не дает информации о скорости ее протекания.
Химическая кинетика изучает, закономерности протекания химических реакций во времени, ее задачей является:
- определение скоростей химических реакций;
-
определение пределов их протекания.
То есть такое соотношение исходных веществ и продуктов реакции может быть достигнуто при данных условиях ее проведения. Следовательно, при желании получить продукты реакции с высоким выходом, нужно определить условия реакции, при которых это возможно.
Гомогенные и гетерогенные реакции..
Гомогенные реакции – это реакции, протекающие в одной фазе.
Гетерогенные реакции – это реакции, протекающие на границе раздела фаз.
Фаза – часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачкообразно.
Пример: закрытый стакан с водой двухфазная система.
Фаза – это гомогенная часть гетерогенной системы.
Реагирующие системы характеризуются также по числу компонентов.
Компонент системы – это каждое индивидуальное вещество системы, находящееся в определенном физическом состоянии. Примером гомогенных систем служат любые реакции, проходящие в газообразном состоянии, то есть в газовой среде.
Гетерогенные реакции распространены в природе и технике и к ним относятся процессы сжигания твердого и жидкого топлива и процессы коррозии металла. Эти реакции протекают на границе раздела фаз.
Скорость реакции.
В ходе реакции постоянно изменяется количество реагирующих веществ в соответствии с их стехиометрическими отношениями, поэтому для контроля скорости достаточно определять количество хотя бы одного из реагирующих веществ, концентрацию всех других можно рассчитать из уравнения реакции, то все остальные будут изменяться в соответствии с уравнением:
![]()
![]() ,
где
,
где
![]()
![]() -
изменение концентрации одного из
участников концентрации;
-
изменение концентрации одного из
участников концентрации;
![]()
![]() -
промежуток времени, за который это
изменение произошло;
-
промежуток времени, за который это
изменение произошло;
![]() v
- скорость реакции.
v
- скорость реакции.
![]()
![]() -
мгновенная скорость реакции.
-
мгновенная скорость реакции.
![]() Зависимость
скорости реакции от концентрации
выражается
законом «действующих масс»: скорость
реакции прямо пропорционально произведению
концентраций реагирующих веществ, в
степенях равных стехиометрическим
коэффициентам в уравнениях реакций.
Зависимость
скорости реакции от концентрации
выражается
законом «действующих масс»: скорость
реакции прямо пропорционально произведению
концентраций реагирующих веществ, в
степенях равных стехиометрическим
коэффициентам в уравнениях реакций.
![]()
![]()
![]()
![]() -кинетическое
уравнение реакции, где
-кинетическое
уравнение реакции, где
![]() k-
константа скорости.
k-
константа скорости.
![]() Идеальная
скорость реакции, при С(А)=С(В)=1моль/л:
k=v.
Идеальная
скорость реакции, при С(А)=С(В)=1моль/л:
k=v.
![]() Константа
скорости зависит от природы реагирующих
веществ, от температуры.
Константа
скорости зависит от природы реагирующих
веществ, от температуры.
![]()
Влияние температуры на скорость реакции грубо определяется правилом Вант Гоффа. При повышении температуры на каждые 10˚С скорость реакции в среднем увеличится в 2-4 раза.
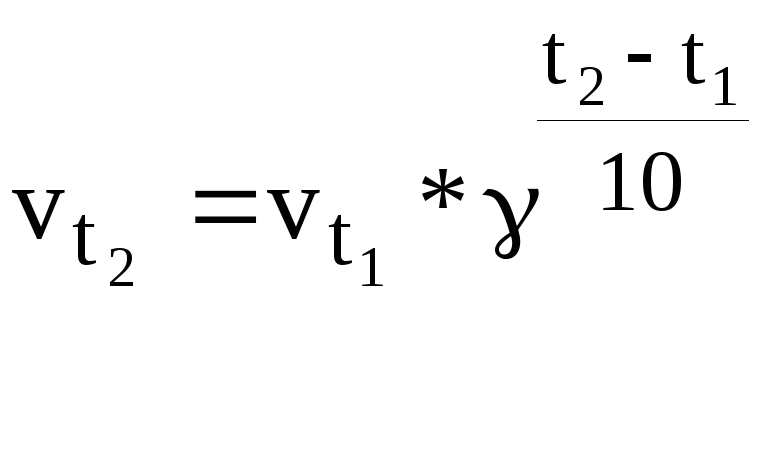
![]() скорость
реакции при температуре
скорость
реакции при температуре
![]() ;
;
![]() -
скорость реакции при температуре
-
скорость реакции при температуре
![]() ;
;
![]() -
температурный коэффициент реакции,
который изменяется от 2 до 4.
-
температурный коэффициент реакции,
который изменяется от 2 до 4.
Точно, зависимость скорости реакции от температуры выражается правилом Аррениуса.
![]()
K – константа скорости
A – эмпирический коэффициент
e – основание натурального логарифма
Eакт – энергия активации
R – газовая постоянная
T – абсолютная температура
Энергия активации – избыточная энергия, необходимая для того, чтобы столкновения между реагирующими частицами были эффективными и заканчивались их взаимодействием.
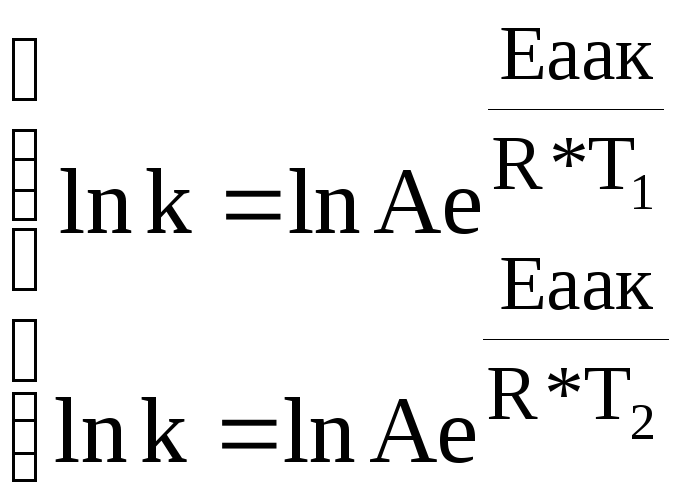
Д![]() ля
того, чтобы для даннной реакции определить
А и Еакт достаточно определить константу
скорости при 2-х разных температурах.
Химическое
равновесие.
ля
того, чтобы для даннной реакции определить
А и Еакт достаточно определить константу
скорости при 2-х разных температурах.
Химическое
равновесие.
Реакция может протекать как в прямом, так и в обратном направлении.
![]()
Кинетическое уравнение для прямой и обратной реакции
![]()
Состояние реакции системы, при котором скорость прямой реакции равна скорости обратной, называется состоянием химического равновесия. Любая реакция, протекающая в данных условиях в определенный момент времени достигнет состояния равновесия. Состояние равновесия характеризует величина – константа равновесия (Кр).
![]()
Константы равновесия показывает, что в условии равновесия концентрации всех веществ взаимосвязаны, их называют равновесными. Кроме того, если К>1, то в условии равновесия в реакционной смеси преобладают продукты реакции, а если K<1 – исходные вещества. Следовательно, при определении условий обеспечивающих равновесия с K>1, определяют возможность использования данной реакции для получения продуктов реакции.
