
- •Часть 2.
- •Список сокращений и обозначений
- •Глава 1. Введение
- •1.1. Периодическая система
- •1.2. Основные свойства элементов
- •1.2.1. Характеристики изолированных атомов
- •1.2.2. Характеристики элементов в составе соединений
- •1.3. Нахождение в природе. Способы получения простых веществ
- •Глава 2.Водород
- •2.1. Распространенность водорода
- •2.2. Сходство водорода с другими элементами
- •2.2.1. Сходство с галогенами
- •2.2.2. Сходство со щелочными металлами
- •2.3. Особенности водорода
- •2.4. Получение водорода. Водородная энергетика
- •Глава 3. Галогены
- •3.1. Общая характеристика. Нахождение в природе
- •3.2. Получение простых веществ.
- •3.3. Физические свойства г2
- •3.4. Химические свойства галогенов
- •3.4.1. Галогены как окислители
- •3.4.2. Взаимодействие г2 с водородом. Получение hCl и ее свойства. Галогеноводородные кислоты
- •3.4.3. Окислительно-восстановительные реакции в водных растворах. Кислородосодержащие соединения хлора
- •Глава 4. Халькогены
- •4.1. Общая характеристика. Нахождение в природе. Получение
- •4.2. Структура и физические свойства простых веществ
- •4.3. Химические свойства и применение простых веществ
- •4.4. Вода и сероводород. Сульфиды
- •4.5. Перхалькогениды
- •4.6. Кислородосодержащие соединения серы
- •4.7. Экологический аспект переработки сульфидных руд
- •Глава 5. Азот и фосфор
- •5.1. Общая характеристика. Нахождение в природе. Получение
- •5.2. Простые вещества
- •5.2.1. Структура и физические свойства
- •5.2.2. Химические свойства
- •5.3. Аммиак и соли аммония
- •5.3.1. Получение аммиака
- •5.3.2. Физические и химические свойства
- •5.3.3. Соли аммония
- •5.4. Оксиды и гидроксиды азота. Соли
- •5.4.1. Получение оксидов и кислот
- •5.4.2. Свойства и применение
- •5.4.3. Нитраты и нитриты
- •5.5. Кислородосодержащие соединения фосфора
- •5.6. Минеральные удобрения
- •Глава 6. Углерод и кремний
- •6.1. Общая характеристика. Нахождение в природе. Получение
- •6.2. Структура и физические свойства простых веществ
- •6.3. Химические свойства простых веществ
- •6.4. Метан
- •6.5. Кислородосодержащие соединения углерода
- •6.5.1. Общая характеристика и свойства
- •6.5.2. Токсичность оксидов
- •6.5.3. Синтез и обнаружение диоксида углерода
- •6.5.4. Применение со2 и проблемы его утилизации
- •6.6. Кислородосодержащие соединения кремния. Стекло. Цемент
- •6.6.1. Оксид. Гидроксид. Соли
- •6.6.2. Нерастворимые стекла
- •6.6.3. Цемент
- •6.7. Уголь и силикагель как сорбенты
- •Глава 7. Металлы
- •7.1. Общая характеристика
- •7.2.2. Жесткость воды и способы ее устранения
- •7.2.3. Получение и свойства s-металлов
- •7.2.4. Сложные вещества s-элементов. Производство соды
- •7.3.1. Общая характеристика. Степени окисления
- •7.3.2. Природные соединения алюминия
- •7.3.3. Физические свойства
- •7.3.4. Химические свойства
- •7.3.5. Оксиды и соли p-элементов
- •7.3.6. Производство алюминия
- •7.4.1. Общая характеристика
- •7.4.2. Нахождение d-элементов в природе
- •7.4.3. Получение d-металлов
- •7.4.4. Физические свойства
- •7.4.5. Химические свойства d-металлов
- •7.4.6. Сложные соединения d-элементов. Сплавы
- •Рекомендуемая литература.
- •Содержание
- •Глава 1. Введение 4
2.3. Особенности водорода
Одна из особенностей водорода состоит в том, что его простое вещество Н2 имеет минимальную молекулярную массу (Мr) и, значит, является самым легким газом (в 14,5 раз легче воздуха, поэтому им наполняют стратостаты, дирижабли и т.п.).
Легкостью водорода объясняется низкое его содержание в атмосфере (всего 10‑4%), хотя на Земле постоянно идут процессы образования Н2. Например, при разложении органических веществ без доступа воздуха. Выделяется он и во время извержения вулканов, при бурении нефтяных скважин (в составе природного газа), а также зелеными листьями растений (при их дыхании).
Однако, почти весь
водород улетучивается на высоту примерно
100 км, где атомизируется и ионизируется
до
![]() ,
пополняя т.н. «протонный пояс» Земли.
(Именно порывы «протонного ветра»
(считают ученые) являются причиной
северных сияний, а также нарушений
радиосвязи.)
,
пополняя т.н. «протонный пояс» Земли.
(Именно порывы «протонного ветра»
(считают ученые) являются причиной
северных сияний, а также нарушений
радиосвязи.)
Другой особенностью
водорода является то, что энергия
связи Н–Н очень велика – составляет
435 кДж/моль. (Самая прочная из всех
ординарных ХС.) Это объясняется тем, что
в
![]() единственные 2 электрона двумя
«голыми»
ядрами притягиваются особенно
сильно, а значит, прочно фиксируются
между ними.
единственные 2 электрона двумя
«голыми»
ядрами притягиваются особенно
сильно, а значит, прочно фиксируются
между ними.
Как следствие:
а) для реакций с участием Н2 высока энергия активного состояния Еа.с., т.е. процессы идут в достаточно жестких условиях. Например, сероводород (H2S) образуется при пропускании струи водорода над кипящей серой. Таким образом, Н2 не только термодинамически, но и кинетически пассивнее, чем Г2 или ЩМ.
б) из-за большой
прочности и, как следствие, жесткости
связи Н–Н молекулы водорода (неполярные)
обладают незначительной поляризуемостью.
А значит, способны лишь к очень
слабым дисперсионным взаимодействиям
с другими частицами, в том числе, с
молекулами растворителей. Поэтому
ничтожна
растворимость
![]() не только в воде, но и в органических
жидкостях.
не только в воде, но и в органических
жидкостях.
в) особенно слабы
дисперсионные взаимодействия молекул
водорода между собой. К тому же,
частицы
![]() из-за их малой
из-за их малой
![]() крайне подвижны (наиболее подвижные
среди всех молекул). И потому требуется
особенно глубокое охлаждение
для сжижения2
водорода. Как следствие (и ничтожной
величины дисперсионных взаимодействий,
и минимального значения Мr),
крайне подвижны (наиболее подвижные
среди всех молекул). И потому требуется
особенно глубокое охлаждение
для сжижения2
водорода. Как следствие (и ничтожной
величины дисперсионных взаимодействий,
и минимального значения Мr),
![]() имеет самые низкие
(после гелия3)
температуры кипения (т.кип.) и плавления
(т.пл.): –252,2°С и –259,1°С соответственно.
Это используется для отделения водорода
от других газов (исключая гелий) cнижением
температуры, достаточным для вымораживания
всех веществ, кроме Н2.
имеет самые низкие
(после гелия3)
температуры кипения (т.кип.) и плавления
(т.пл.): –252,2°С и –259,1°С соответственно.
Это используется для отделения водорода
от других газов (исключая гелий) cнижением
температуры, достаточным для вымораживания
всех веществ, кроме Н2.
Третья особенность
водорода состоит в том, что, в отличие
от иных катионов,
![]() не
имеет
электронов. Следствием этого является
следующее:
не
имеет
электронов. Следствием этого является
следующее:
а) ион Н+,
приближаясь к другим атомам, не испытывает
межэлектронного отталкивания
(ибо нечем отталкиваться от е другого
элемента). Поэтому положительно заряженный
водород одной молекулы может образовать
дополнительную прочную связь с
атомом элемента соседней молекулы, если
этот атом достаточно
отрицательно заряжен. Как, например,
F, O или N в соединениях HF,
![]() и
и
![]() соответственно (а также в органических
веществах, содержащих эти элементы).
Такие связи между молекулами
называются водородными.
Они
направлены, насыщаемы и
значительно прочнее,
чем межмолекулярные связи.
соответственно (а также в органических
веществах, содержащих эти элементы).
Такие связи между молекулами
называются водородными.
Они
направлены, насыщаемы и
значительно прочнее,
чем межмолекулярные связи.
б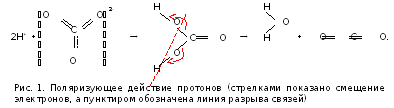 )
являясь «голым» протоном, катион водорода
имеет повышенную электрофильность
(т.е. любовь к е). Поэтому в соединениях,
в частности, в кислородосодержащих
кислотах,
)
являясь «голым» протоном, катион водорода
имеет повышенную электрофильность
(т.е. любовь к е). Поэтому в соединениях,
в частности, в кислородосодержащих
кислотах,
![]() в значительной степени перетягивает
электроны на себя (что на рисунке 1
отражено стрелками). Это, во-первых,
ослабляет связи в анионе, а
во-вторых, делает его несимметричным,
а потому менее устойчивым. Такое
явление называют поляризующим
действием катиона на анион или
поляризацией.
в значительной степени перетягивает
электроны на себя (что на рисунке 1
отражено стрелками). Это, во-первых,
ослабляет связи в анионе, а
во-вторых, делает его несимметричным,
а потому менее устойчивым. Такое
явление называют поляризующим
действием катиона на анион или
поляризацией.
В частности, из-за сильного поляризующего действия Н+ на карбонат-анион угольная кислота настолько нестабильна, что существует только в разбавленных растворах, а при попытке выделить ее в свободном состоянии полностью распадается на оксиды. Механизм распада показан на рис. 1, а в краткой форме этот распад отражается уравнением:
![]() .
.
В то же
время карбонат натрия (![]() )
даже плавится (при 8580С) без
разложения, ибо
)
даже плавится (при 8580С) без
разложения, ибо
![]() очень слабо поляризует анион
из-за низкой ЭО натрия (0,9), гораздо
меньшей, чем ЭО водорода (2,1). Другие
металлы тоже имеют ЭО ниже, чем Н, и это
одна из причин, по которой кислоты
менее устойчивы, чем их соли.
очень слабо поляризует анион
из-за низкой ЭО натрия (0,9), гораздо
меньшей, чем ЭО водорода (2,1). Другие
металлы тоже имеют ЭО ниже, чем Н, и это
одна из причин, по которой кислоты
менее устойчивы, чем их соли.
