
- •Классификация электромагнитного излучения в зависимости от длины волны
- •Химические процессы в верхних слоях атмосферы
- •Озоновый слой. Механизм образования, механизм разрушения, последствия. Озоноразрушающие вещества
- •Химические процессы в тропосфере с участием свободных радикалов
- •Химический смог и фотохимический смог. Механизм образования и принципиальные отличия
- •Вода в атмосфере
- •Парниковый эффект. Физико-химическая сущность явления
Классификация электромагнитного излучения в зависимости от длины волны
|
Вид излучения |
, нм |
|
-излучение |
(1-5) 10- 4 |
|
Рентгеновское |
110-3-20 |
|
Ультрафиолетовое |
20-400 |
|
Видимое |
400-800 |
|
Инфракрасное |
800-800000 |
Химические процессы в верхних слоях атмосферы
Верхние слои атмосферы в значительной мере определяют условия жизни на поверхности Земли. Они играют роль защитного барьера на пути излучений и частиц высокой энергии.
Химические процессы в атмосфере начинаются с высоты 250 км, когда концентрация газов (N2 и О) достигает 109 см-3 и становится заметным поглощение жесткой УФ-составляющей солнечной радиации.
Одним из важных процессов, протекающих в верхних слоях атмосферы, является диссоциация О2 с образованием атомарного кислорода:
O2 + h O(1D) + O(3P),
3P – основное состояние - триплетное
1D – возбужденное состояние - синглетное
В силу этой реакции начиная с высоты порядка 100 км кислород в атмосфере находится как в молекулярной, так и в атомарной формах (рис. 6). На высоте 130 км содержание О2 и О примерно одинаково.
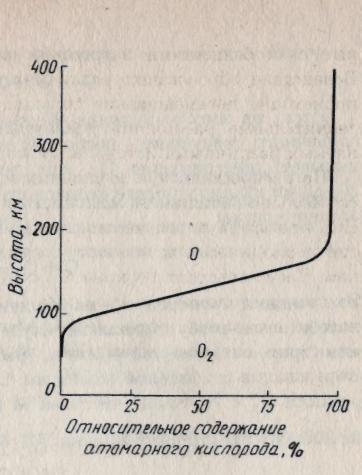
Рис. Распределение кислорода по высоте
На высоте 90 км и выше N2, О2 и О поглощают наиболее коротковолновую радиацию с последующей ионизацией:
N2 + h (80 нм) N2+ + е-
02 + h (99,3 нм) О2+ + е-
0 + h (91,2 нм) 0+ + е-
NO + h (134,5 нм) NO+ + е-
Как видно из значений длин волн, при которых протекают эти реакции, молекулярный азот имеет наиболее высокую энергию ионизации, тогда как N0 — наиболее низкую.
Образующиеся ионы участвуют затем в диссоциативной рекомбинации:
N2+ + е- N + N
02+ + е- О + О
N0+ + е- N + О
в реакциях переноса заряда:
N2+ + 02 N2 + 02+
О+ + О2 О + О2+
02+ + N0 02 + N0+
N2+ + NO N2 + N0+
в реакциях переноса заряда с разрывом связи (обмен атомом):
0+ + N2 N + N0+
N2+ + О N + N0+
Все эти разнохарактерные реакции экзотермичны и протекают с участием газовых катионов. Большинство реакций такого рода происходят безактивационно.
Ион NO+ исчезает лишь в результате диссоциативной рекомбинации. В реакциях другого типа в силу низкого потенциала этот ион не участвует. Реакции N0+ с нейтральными частицами эндотермичны, т.е. требуют энергии активации. "Тупиковый" характер N0+ определяет то, что эта частица является основной катионной составляющей ионосферы (верхняя часть термосферы).
В целом термосфера характеризуется как зона протекания безактивационных бимолекулярных реакций. В силу низких концентраций газов в этой зоне практически не реализуются тримолекулярные экзотермические реакции:
N + N + M N2 + M*
О + О + М 02 + М*
Озоновый слой. Механизм образования, механизм разрушения, последствия. Озоноразрушающие вещества
Итак, на высоте порядка 90 км большая часть коротковолнового солнечного излучения поглощается, однако излучение, способное вызывать диссоциацию О2 , еще достаточно интенсивно. На высоте 30-50 км взаимодействие атомарного кислорода с О2 приводит к образованию озона:
О + О2 О3*
Эта реакция происходит и на больших высотах. Однако образующаяся колебательно-возбужденная молекула озона с малым характеристическим временем мономолекулярно распадается на исходные частицы. Образование стабильной молекулы О3 происходит лишь в результате реакции О3* с "третьей" частицей М (О2 или N2) с тепловым рассеянием колебательного возбуждения:
О3* + М О3 + М*
или
О(3Р) + О2 + М О3 + М*; Н<0
С понижением высоты скорость образования О3 увеличивается пропорционально произведению [О2]([О2] + [N2]) и уменьшается из-за поглощения света с < 240 нм, что определяет наличие максимума содержания озона на высоте около 25 км.
Тепловое рассеивание энергии на этой высоте происходит в результате реакции
О + О3 2О2 ; Н<0
— первой из значимых реакций, имеющей активационный барьер (13,6 кДж/моль).
Наряду с этой реакцией к уменьшению концентрации О3 в стратосфере ведет наиболее существенная для сохранения жизни на суше реакция поглощения солнечного света с < 310 нм:
03 + h (310 нм) О2 + O(1D)
Особенно эффективно поглощается свет в диапазоне длин волн 200-310 нм. Другие атмосферные газы в этом диапазоне длин волн поглощают свет не столь эффективно.
Процесс образования и разложения озона по вышеуказанным реакциям называют циклом Чепмена или нулевым циклом.
В нулевом цикле не происходит изменения химического состава системы, в нем поддерживается лишь то или иное ее стационарное состояние, причем солнечный свет переходит в теплоту. Этот озоновый нулевой цикл и ответствен в стратосфере за повышение температуры до высоты 50 км.
Экспериментальные измерения содержания О3 обнаруживают в стратосфере меньшую его концентрацию, чем следует из цикла Чепмена. Связано это с присутствием в стратосфере веществ — катализаторов разложения озона. Среди таких катализаторов наиболее важная роль принадлежит оксидам азота:
N0 + О3 N02 + 02
N02 + О NO + 02
О3 + О 202
а также атомам хлора:
Сl + О3 СlO + О2
СlO + О O2 + Сl
О3 + О 2О2
В качестве катализатора выступает и ОН-радикал:
ОН + О3 О2 + Н02
НО2+ О О2 + ОН
О3 + О 2О2
Радикал ОН может также катализировать разложение О3 по иному пути:
ОН + О3 О2 + НО2
НО2 + Оз 2О2 + ОН
О3 + О3 3О2
Происхождение N0, ОН и Сl возможно в результате различных процессов. Так, N0 образуется в двигателях внутреннего сгорания. Соответственно запуск ракет и сверхзвуковых самолетов приводит к разрушению озонового слоя.
В любом двигателе внутреннего сгорания развиваются настолько высокие температуры, что из атмосферного кислорода и азота образуется N0:
N2 + О2 2NО
Атомарный хлор образуется в результате фотохимического разрушения ряда фреонов (хлорфторуглеводородов). Эти вещества летучи, устойчивы в тропосфере. Они широко применяются в холодильных установках и в аэрозольных баллончиках. Просачиваясь из тропосферы в стратосферу, они попадают под действие жесткого УФ-излучения и распадаются:
CF2Cl2 + h CF2Cl + Сl
Последующие реакции CF2C1 с 02 и + h приводят к отщеплению второго атома хлора.
В образовании ОН наиболее существенны процессы, связанные с участием паров воды. Несмотря на то что на высоте 30 км содержание их всего 3 млн-1, здесь проходит реакция
Н20 + h Н + ОН
Кроме того, как указывалось выше, при фотолизе О3 образуется атомарный кислород в электронно-возбужденном (1D) состоянии. Взаимодействие 0(1D) с молекулами Н20, диффундирующими из тропосферы в стратосферу, происходит безактивационно с образованием ОН:
O(1D) + Н2О 2 ОН
