
- •Модуль II Тема занятия №1: “Многоатомные алифатические и ароматические спирты. Полиамины. Аминоспирты.”
- •Классификация спиртов
- •Гомологический ряд одноатомных спиртов.
- •Радикало-функциональная и заместительная номенклатуры спиртов.
- •Изомерия спиртов.
- •Строение спиртов.
- •Химические свойства
- •Многоатомные спирты
- •Физические свойства спиртов.
- •Классификация фенолов.
- •Номенклатура и изомерия.
- •Строение фенола, взаимное влияние бензольного кольца и гидроксильной группы.
- •Физические свойства.
- •Химические свойства.
- •Фенол. Резорцин. Адреналин. Применение в медицине. Трехатомные фенолы.
- •По характеру углеводородного радикала различают:
- •Строение молекулы амина
- •Диамины.
- •Аминоспирты
- •Вопросы для самоконтроля:
- •Упражнения
- •Лабораторная работа
- •Тесты для самостоятельной работы студентов Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Ответы к тестам “Спирты. Амины. Тиолы.”
Модуль II Тема занятия №1: “Многоатомные алифатические и ароматические спирты. Полиамины. Аминоспирты.”
Цель занятия: изучение номенклатуры, классификации, строения, и химических свойств спиртов и фенолов, аминов и аминоспиртов.
Студент должен знать:
- классификацию спиртов, фенолов и аминов;
- номенклатуру спиртов, фенолов и аминов;
- строение спиртов, фенолов, аминов и аминоспиртов;
- химические свойства спиртов, фенола, аминов и аминоспиртов.
Студент должен уметь:
- называть по заместительной номенклатуре спирты, фенолы, амины и аминоспирты;
- сравнивать по кислотности спирты, по основности амины;
- сравнивать реакционную способность одноатомных и многоатомных спиртов, алифатических и ароматических (фенолов) спиртов, алифатических и ароматических аминов.
Спирты - это производные углеводородов, в молекулах которых один или несколько атомов Н замещены на –ОН группу.
Классификация спиртов
I. По количеству групп ОН различают: одноатомные, двухатомные и многоатомные спирты:
СН3СН2ОН
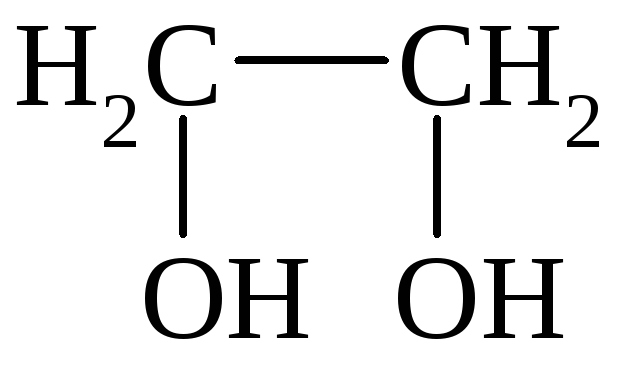

Этанол Этиленгликоль Глицерин
II. По характеру углеводородного радикала различают:
-
предельные СН3-СН2-ОН - этанол
-
непредельные СН2 = СНСН2ОН – пропен-2-ол
-
циклические
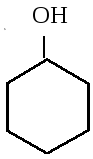 циклогексанол
циклогексанол
-
ароматические
 бензиловый
спирт
бензиловый
спирт
Гомологический ряд одноатомных спиртов.
Первым членом гомологического ряда спиртов является метанол Н3С – ОН, каждый последующий член гомологического ряда отличается на группу СН2 (гомологическую разницу)
|
Формула спирта
|
Название по радикало-функциональной номенклатуре |
Название по заместительной номенклатуре |
|
СН3ОН |
метиловый спирт |
метанол |
|
С2Н5ОН |
этиловый спирт |
этанол |
|
С3Н7ОН |
пропиловый спирт |
пропанол |
|
С4Н9ОН |
бутиловый спирт |
бутанол |
|
С5Н11ОН |
амиловый спирт |
пентанол |
|
С6Н13ОН |
гексиловый спирт |
гексанол |
Радикало-функциональная и заместительная номенклатуры спиртов.
Название спиртов по заместительной номенклатуре ИЮПАК образуется от названия соответствующих алканов прибавлением окончания «ол»; по радикало – функциональной номенклатуре название образуется от названия соответствующего радикала с добавлением окончания «-овый спирт».
Нумерация главной цепи начинают с того конца, ближе к которому находится группа ОН.
В зависимости от того, при каком атоме углерода находится гидроксильная группа, различают первичные (пропанол-1), вторичные (пропанол-2) и третичные (2-метилпропанол-2) спирты.
![]()


пропанол-1 пропанол-2 2-метилпропанол-2
Изомерия спиртов.
Для спиртов характерна структурная изомерия:
-
Изомерия углеродной цепи;
![]()
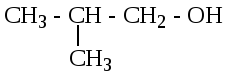
бутанол-1 2-метилпропанол-1
-
Изомерия положения функциональной группы.
![]() пропанол-1
пропанол-1 пропанол-2
пропанол-2
Физические свойства спиртов. Водородная связь.
Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества. Отсутствие газообразных спиртов объясняется способностью молекул к образованию межмолекулярных водородных связей. Первые представители спиртов (метанол, этанол, пропанол) смешиваются с водой в любых соотношениях за счет образования водородной связи с молекулами воды. С ростом молекулярной массы растворимость спиртов в воде резко падает. Высшие спирты практически нерастворимы в воде.
Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и неприятный. Высшие спирты практически не имеют запаха, а третичные спирты обладают неприятным запахом плесени.
Спирты обладают аномально высокими температурами кипения по сравнению с алканами, тиолами простыми эфирами. Эти различия объясняются наличием межмолекулярных связей в молекулах спиртов.
Механизм образования межмолекулярных связей.
Атом кислорода в молекуле спирта обладает большой электроотрицательностью и оттягивает на себя электронную плотность от атома водорода. при этом на атоме водорода возникает δ+, а на атоме кислорода δ-. Поэтому атом водорода электростатически притягивается к атому кислорода другой молекулы и между ними возникает водородная связь. Молекулы связанные между собой водородными связями, образуют ассоциаты.

Образование ассоциатов как бы увеличивает массу спирта и понижает его летучесть. Для разрыва этих связей требуется дополнительная энергия, этим и объясняется высокие температуры кипения.
Наибольшую склонность к образованию водородных связей проявляют первичные спирты. Для вторичных и особенно третичных спиртов способность к ассоциации снижается, так как образованию водородных связей препятствуют разветвленные углеводородные радикалы.
