
- •Термодинамика
- •1. Некоторые понятия термодинамики
- •1. Атомная единица массы (а.Е.М.).
- •2. Термодинамические системы. Первый закон термодинамики
- •2.1. Понятие термодинамической системы
- •2.2. Состояние термодинамической (тд) системы
- •2.3. Внутренняя энергия тд системы (§ 82)
- •2.4. Работа системы и работа над системой (§ 84)
- •2.5. Понятие температуры (§ 85)
- •2.6. Первый закон термодинамики (§ 83)
- •3. Идеальный газ
- •3.1. Понятие идеального газа
- •3.2. Закон Авогадро
- •3.3. Уравнение состояния идеального газа
- •3.4. Внутренняя энергия идеального газа
- •3.5. Теплоёмкость термодинамической системы
- •3.6. Теплоёмкости идеального газа
- •4. Изопроцессы в идеальном газе
- •4.1. Уравнения изопроцессов
- •4.2. Теплоёмкости идеального газа при изопроцессах
- •4.3. Работа идеального газа при изопроцессах
- •4.4. Адиабатный процесс в тропосфере
- •4.5. Изотермическая модель атмосферы
- •5. Второй закон термодинамики
- •5.1. Формулировки второго закона
- •5.2. Цикл Карно
- •5.3. Кпд машины Карно
- •5.4. Теорема Карно
- •5.5. Холодильная машина
- •5.6. Неравенство Клаузиуса
- •5.7. Энтропия
- •5.8. Закон возрастания энтропии
5.7. Энтропия
Так как приведённая теплота системы при обратимом процессе не зависит от формы пути 1-2, а только от состояний системы в точках 1 и 2, то можно записать:
![]() =S(2)−S(1)=ΔS12,
(12)
=S(2)−S(1)=ΔS12,
(12)
где S – это некоторая функция состояния системы в данной точке. Она называется энтропией системы в этой точке и является одним из важнейших понятий в термодинамике.
А
так как S
− функция состояния, то при элементарном
обратимом процессе она является полным
дифференциалом:
![]() .
Отсюда следует, что при адиабатном
обратимом
процессе, когда dQ=0,
энтропия S=const,
т.е.
.
Отсюда следует, что при адиабатном
обратимом
процессе, когда dQ=0,
энтропия S=const,
т.е.
 .
.
Однако формула (12) определяет не саму энтропию системы, а лишь разность энтропий в двух состояниях. Саму же энтропию S какого-либо состояния можно вычислить лишь после того, как будет определена энтропия какого-либо одного состояния.
Вальтер Нернст сформулировал постулат, называемый иногда третьим законом термодинамики: энтропия любого тела при абсолютном нуле равна нулю: S|Т=0=0. Это не совсем очевидно, так как интеграл (12) при Т→0 может и не сходиться. Однако обычно энтропию системы вычисляют не от Т=0, а от некоторого стандартного состояния М0, в котором полагают S(М0)=0. Тогда энтропия системы в произвольной точке М определяется так:
 ,
(13)
,
(13)
и она уже является только функцией состояния системы в точке М. Процесс М0→М может идти по любому пути, но он непременно должен быть обратим.
Пример. Вычислить изменение энтропии идеального газа в обратимом процессе.
Решение.
Запишем первый закон термодинамики для
идеального газа:
![]()
Подставляя
сюда из уравнения состояния
![]() ,
получаем:
,
получаем:
![]() .
.
И тогда, по определению,
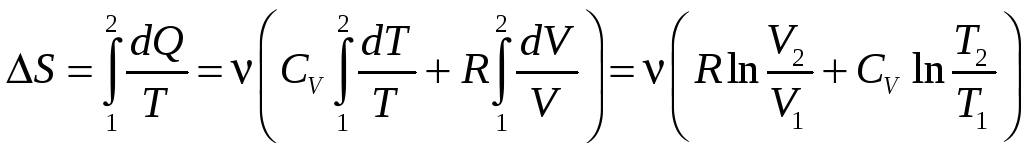 .
.
5.8. Закон возрастания энтропии
На основе неравенства Клаузиуса (10) можно доказать следующую важную теорему: энтропия полностью изолированной системы ни при каких процессах не может убывать; она либо остаётся постоянной, если процесс обратим, либо возрастает, если в нём есть необратимые стадии:
ΔS12=S2−S1≥0, т.е. S2≥S1 (без доказательства).
Это утверждение носит название закона возрастания энтропии.
Замечание 1. Неравенство ΔS≥0 применимо только к полностью изолированным системам. Если система не является изолированной, то её энтропия может и убывать в любых процессах, но энтропия внешней среды при этом возрастает на столько же, или ещё больше.
Замечание 2. Формула (12) даёт термодинамическое определение энтропии, из которого не вполне понятен её физический смысл. Этот смысл проясняется из статистического толкования энтропии:
S=k lnN,
где k – постоянная больцмана, N – число микросостояний системы, которыми реализуется её данное макросостояние, характеризующееся параметрами p,V,Т.
Пример. Тепловой контакт двух тел с разными температурами Т1 и Т2 приводит к необратимому процессу теплопередачи.
Пусть горячий камень с температурой Т2 бросили в холодную воду с температурой Т1. Камень отдаёт воде тепло ΔQ при своей температуре Т2>Т1, следовательно, его энтропия изменяется на величину ΔS2=−ΔQ/Т2 (убывает). Вода поглощает то же тепло, но уже при своей температуре Т1<Т2, следовательно, её энтропия изменяется на величину ΔS1=+ΔQ/Т1 (возрастает). Тогда общее изменение энтропии системы «вода-камень»:
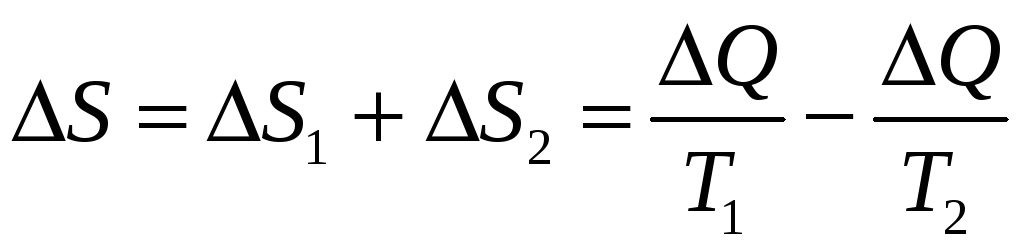 >0.
>0.
