
- •1.1. Основные определения и термины
- •1.2.Внутренняя энергия
- •1.3.Энтропия
- •1.4.Фундаментальные уравнения Гиббса в энергетическом и энтропийном выражении как основные соотношения (уравнения) термодинамики.
- •1.5. Термодинамические потенциалы как характеристические функции состояния
- •1.5.1. Основные типы термодинамических потенциалов
- •1.5.2.Важнейшие дополнительные соотношения между термодинамическими величинами.
- •1.5.2. Условия эволюции макроскопических систем в равновесное состояние.
1.5.2.Важнейшие дополнительные соотношения между термодинамическими величинами.
А. Уравнения Гиббса-Гелмгольца.
Эти уравнения позволяют переходить от
одного термодинамического потенциала
к другому, т.е. рассчитывать (в обобщенном
выражении) Ψk(Pk),
если дано Ψl(Pk):
![]() .
На практике важнейшее значение имеют
три частных случая уравнений
Гиббса-Гелмгольца:
.
На практике важнейшее значение имеют
три частных случая уравнений
Гиббса-Гелмгольца:
а)
![]() -
позволяет рассчитывать энтальпию, если
известна внутренняя энергия как функция
давления.
-
позволяет рассчитывать энтальпию, если
известна внутренняя энергия как функция
давления.
б)
![]() -
позволяет рассчитывать свободную
энергию Гельмгольца, если известна
внутренняя энергия как функция
температуры.
-
позволяет рассчитывать свободную
энергию Гельмгольца, если известна
внутренняя энергия как функция
температуры.
в)
![]() -
позволяет рассчитывать свободную
энергию Гиббса, если известна энтальпия
как функция температуры.
-
позволяет рассчитывать свободную
энергию Гиббса, если известна энтальпия
как функция температуры.
г)
![]() -
позволяет рассчитывать свободную
энергию Гиббса, если известна свободная
энергия Гельмгольца как функция объема,
например, из статистических расчетов.
-
позволяет рассчитывать свободную
энергию Гиббса, если известна свободная
энергия Гельмгольца как функция объема,
например, из статистических расчетов.
д)![]() -
позволяет рассчитывать свободную
энергию Гиббса, если известна энтальпия
как функция температуры. Общее решение
этого уравнения имеет вид:
-
позволяет рассчитывать свободную
энергию Гиббса, если известна энтальпия
как функция температуры. Общее решение
этого уравнения имеет вид:
![]() ,
где I – термодинамически
неопределенная постоянная, зависящая
от давления. В соответствие с теоремой
Нернста (третьим законом термодинамики)
,
где I – термодинамически
неопределенная постоянная, зависящая
от давления. В соответствие с теоремой
Нернста (третьим законом термодинамики)
![]() при Т=0 I=0 и
при Т=0 I=0 и
![]() .
.
Уравнение д) является практически
наиболее важным, так как применимо для
наиболее часто встречающихся условий
при анализе конденсированных материальных
систем. Функцию Н(Т) можно получить
интегрированием уравнения
![]() ,
если известна легко экспериментально
определяемая величина теплоемкости
при постоянном давлении. Величину G
как функцию Т можно определить
интегрированием уравнений в) и д):
,
если известна легко экспериментально
определяемая величина теплоемкости
при постоянном давлении. Величину G
как функцию Т можно определить
интегрированием уравнений в) и д):
![]() и
и
![]() соответственно, с определением констант
интегрирования, или по уравнению г)
без интегрирования, если F
известна иp статистических
расчетов. Уравнения д) можно также
легко преобразовать в соотношение
соответственно, с определением констант
интегрирования, или по уравнению г)
без интегрирования, если F
известна иp статистических
расчетов. Уравнения д) можно также
легко преобразовать в соотношение![]() ,
которое можно записать в изменениях
свободной энергии Гиббса и энтальпии
,
которое можно записать в изменениях
свободной энергии Гиббса и энтальпии
![]() ,
позволяющее определять тепловые эффекты
(
,
позволяющее определять тепловые эффекты
(![]() )
равновесных процессов (химических
реакций, процессов растворения и фазовых
переходов) через их «стандартную энергию
Гиббса».
)
равновесных процессов (химических
реакций, процессов растворения и фазовых
переходов) через их «стандартную энергию
Гиббса».
Б. Соотношения Максвелла.
Как уже указывалось, основные
термодинамические функции состояния
(U,S,F,G)
являются характеристическими функциями
многих независимых переменных, содержащих
все термодинамические сведения о
системе. Полный дифференциал функции
многих переменных Y(x1,x2,…,xn)
выражается через первые частные
производные в виде:
![]() ,
причем отдельные их слагаемые не являются
дифференциалами, так как их интегралы
мрогут принимать любые значения с учетом
констант интегрирования. Первые частные
производные таких функций по интенсивным
независимым переменным дают экстенсивные
параметры, а по экстенсивным – измеряемые
и регулируемые интенсивные параметры
,
причем отдельные их слагаемые не являются
дифференциалами, так как их интегралы
мрогут принимать любые значения с учетом
констант интегрирования. Первые частные
производные таких функций по интенсивным
независимым переменным дают экстенсивные
параметры, а по экстенсивным – измеряемые
и регулируемые интенсивные параметры
![]()
![]() ,
где Y – характеристическая
функция, Pi
- интенсивные и Xi
- экстенсивные параметры (более подробно
– см. раздел 3). Их вторые частные
производные дают дополнительные
измеримые величины. Воспользовавшись
хорошо разработанной теорией таких
функций и используя ее основополагающие
соотношения (для трех переменных x,y,z,
которые могут быть представлены к в
виде функции двух других, т.е. x=х(y,z);
y=у(х,z);
z=z(х,у):
,
где Y – характеристическая
функция, Pi
- интенсивные и Xi
- экстенсивные параметры (более подробно
– см. раздел 3). Их вторые частные
производные дают дополнительные
измеримые величины. Воспользовавшись
хорошо разработанной теорией таких
функций и используя ее основополагающие
соотношения (для трех переменных x,y,z,
которые могут быть представлены к в
виде функции двух других, т.е. x=х(y,z);
y=у(х,z);
z=z(х,у):
![]() (смешанные производные не зависят от
порядка дифференцирования);
(смешанные производные не зависят от
порядка дифференцирования);
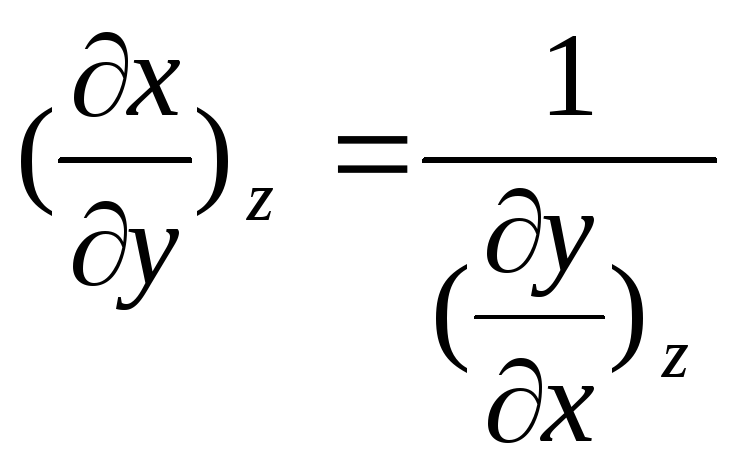 и
и
![]() ,
а для двух разных функций одних и тех
же переменных z=z(х,у)
и f=f(x,y):
,
а для двух разных функций одних и тех
же переменных z=z(х,у)
и f=f(x,y):
![]() ),
Максвелл получил большое количество
дополнительных соотношений между
термодинамическими величинами,
позволяющие связывать трудно измеряемые
параметры с легко измеряемыми. Частными
случаями соотношений Максвелла для
внутренней энергии являются, например:
),
Максвелл получил большое количество
дополнительных соотношений между
термодинамическими величинами,
позволяющие связывать трудно измеряемые
параметры с легко измеряемыми. Частными
случаями соотношений Максвелла для
внутренней энергии являются, например:
![]() ;
;
![]() , откуда
, откуда
![]() т.е
трудно определяемая величина, означающая
прирост температуры на единицу объема
при квазистаитчески-адиабатическом
расширении, равна легко определяемому
повышению давления при подводе единицы
количества теплоты при постоянном
объеме и составе.
т.е
трудно определяемая величина, означающая
прирост температуры на единицу объема
при квазистаитчески-адиабатическом
расширении, равна легко определяемому
повышению давления при подводе единицы
количества теплоты при постоянном
объеме и составе.
Для термодинамических потенциалов в
обобщенном выражении
![]() следует:
следует:![]() ,
,![]() ,
,
![]() (i,m≤k;
j,n>k).
Полученные при этом частные случаи
соотношений Максвелла из свободных
энергий Гельмгольца и Гиббса, а также
из внутренней энергии и энтальпии чаще
всего используются для представления
производных термодинамических функций,
которая легко может быть связана с
экспериментально измеряемыми величинами.
Например, вторая частная производная
свободной энергии Гельмгольца как
функции V и Т дает
соотношение Максвелла в виде:
(i,m≤k;
j,n>k).
Полученные при этом частные случаи
соотношений Максвелла из свободных
энергий Гельмгольца и Гиббса, а также
из внутренней энергии и энтальпии чаще
всего используются для представления
производных термодинамических функций,
которая легко может быть связана с
экспериментально измеряемыми величинами.
Например, вторая частная производная
свободной энергии Гельмгольца как
функции V и Т дает
соотношение Максвелла в виде:
![]() а вторая частная производная свободной
энергии Гиббса как функции р и Т
- в виде:
а вторая частная производная свободной
энергии Гиббса как функции р и Т
- в виде:
![]() .
В обоих соотношениях производную в
правой части сравнительно легко
определить экспериментально. Соотношения
Максвелла позволяют выразить
термодинамические производные через
экспериментально определяемые величины,
в частности (для однокомпонентных
систем): мольную теплоемкость при
постоянном давлении
.
В обоих соотношениях производную в
правой части сравнительно легко
определить экспериментально. Соотношения
Максвелла позволяют выразить
термодинамические производные через
экспериментально определяемые величины,
в частности (для однокомпонентных
систем): мольную теплоемкость при
постоянном давлении
![]() ,
где Sm
- мольная энтропия; термический
коэффициент объемного расширения
,
где Sm
- мольная энтропия; термический
коэффициент объемного расширения
![]() и коэффициент изотермической сжимаемости
(величину, обратную модулю объемного
сжатия)
и коэффициент изотермической сжимаемости
(величину, обратную модулю объемного
сжатия)
![]() ,
коэффициент давления
,
коэффициент давления
 разность мольных теплоемкостей при
постоянном давлении и объеме
разность мольных теплоемкостей при
постоянном давлении и объеме![]() ,
где Vm
- мольный объем.
,
где Vm
- мольный объем.
В.Уравнение Гельмгольца
Из условия независимости вторых
производных фундаментального уравнения
в энтропийном выражении по объему V
и температуре Т (для закрытых систем)
![]() получено
соотношение, получившее название
уравнения Гельмгольца:
получено
соотношение, получившее название
уравнения Гельмгольца:
![]() ,
с помощью которого можно рассчитывать
изотермические изменения внутренней
энергии по известному уравнению
состояния. С помощью этого уравнения
можно показать, что для идеального газа
с уравнением состояния pV=nRT
внутренняя энергия при постоянной
температуре не зависит от объема. Для
N молей реального
газа, состояние которого описывается
уравнением Ван дер Ваальса
,
с помощью которого можно рассчитывать
изотермические изменения внутренней
энергии по известному уравнению
состояния. С помощью этого уравнения
можно показать, что для идеального газа
с уравнением состояния pV=nRT
внутренняя энергия при постоянной
температуре не зависит от объема. Для
N молей реального
газа, состояние которого описывается
уравнением Ван дер Ваальса
![]() :
:
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
