
- •1.1. Основные определения и термины
- •1.2.Внутренняя энергия
- •1.3.Энтропия
- •1.4.Фундаментальные уравнения Гиббса в энергетическом и энтропийном выражении как основные соотношения (уравнения) термодинамики.
- •1.5. Термодинамические потенциалы как характеристические функции состояния
- •1.5.1. Основные типы термодинамических потенциалов
- •1.5.2.Важнейшие дополнительные соотношения между термодинамическими величинами.
- •1.5.2. Условия эволюции макроскопических систем в равновесное состояние.
Раздел 1. Исходные положения классической равновесной (технической и химической) термодинамики (РТД): основные определения, термодинамические функции состояния и независимые переменные, основные соотношения между ними.
1.1. Основные определения и термины
Термодинамика является разделом фундаментальной науки, посвященным обобщенному описанию тепловой и других форм энергии, её передачи и изменения (преобразования из одной формы в другую) в различных системах и процессах. Термодинамика основана на наиболее общих принципах, которые являются универсальными и базируются на опытных данных многих наук. Основные принципы термодинамики универсальны для живой и неживой природы. Объектами описания в термодинамике являются системы: любая совокупность изучаемых объектов, находящаяся в заданной окружающей среде, может быть названа термодинамической системой. Примерами систем могут вещество, материал, техническое устройство, живая клетка, организм, биосфера, Вселенная. В зависимости от взаимодействия с окружающей (внешней) средой выделяют три вида термодинамических систем, находящихся в устойчивом равновесном (термодинамически стабильном) или неравновесном (установившемся, стационарном и или неустановившемся, переходном) состоянии:
Изолированные системы: не обмениваются с внешней средой ни энергией, ни веществом. Таких систем в реальных условиях не существует, но понятие изолированной системы используют для понимания главных термодинамических принципов.
Закрытые системы: обмениваются со средой энергией, но не веществом. Примером такой системы может служить закрытый термос с налитым в него чаем.
Открытые системы: обмениваются с внешней средой как энергией, так и веществом.
В зависимости от размеров все термодинамические системы подразделяются на макроскопические и малые (микро- и нано)системы.
Состояние любой термодинамической системы определяется (характеризуется) набором термодинамических параметров (физических величин), зависящих (экстенсивные величины) и не зависящих (интенсивные величины) от размеров (объема) системы. Классическая равновесная (техническая и химическая) термодинамика описывает равновесные состояния макроскопических материальных систем и устройств с помощью двух важнейших фундаментальных и универсальных экстенсивных параметров – внутренней энергии U и энтропии S, а также их преобразований (термодинамических потенциалов – свободной энергии Гельмгольца и Гиббса, функций Мессье-Планка), которые являются однозначными (характеристическими) функциями состояния любой системы, зависящими от независимых переменных – экстенсивных (объем и состав) и интенсивных (температура, давление, химический потенциал) параметров состояния, которые можно легко измерять, задавать, контролировать или поддерживать постоянными. При выборе в качестве основных функций состояния внутренней и свободной энергии (энергетический подход) энтропия и функции Мессье-Планка являются экстенсивными независимыми переменными и, наоборот, при выборе в качестве основной функции состояния энтропии и функций Мессье-Планка (энтропиный подход) внутренняя и свободная энергия являются экстенсивными независимыми переменными.
Экстенсивные параметры зависят от
размера (объема, массы) системы и могут
быть различными в различных частях
системы, если она гетерогенная
(гетерофазная), а интенсивные – не
зависят от размера системы, причем в
условиях равновесия они одинаковы во
всех ее частях. В качестве независимых
переменных состава обычно используются
числа молей компонентов
![]() ,
причем в этом случае k
– число компонентов равно числу
независимых переменных состава, а также
их мольные (
,
причем в этом случае k
– число компонентов равно числу
независимых переменных состава, а также
их мольные (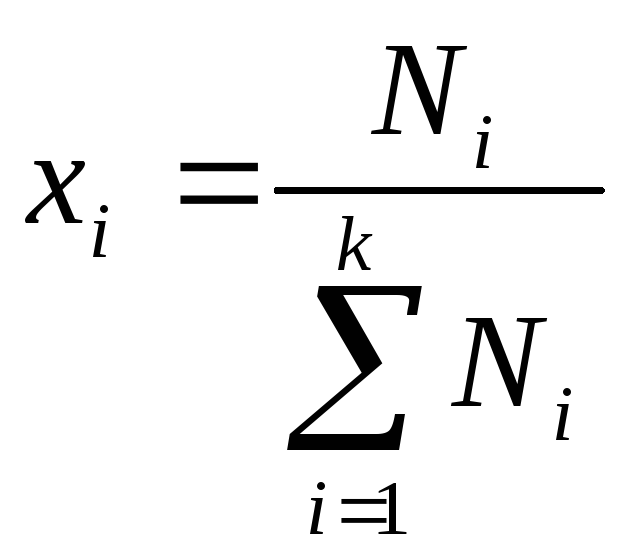 ),
реже удельные (объемные
),
реже удельные (объемные
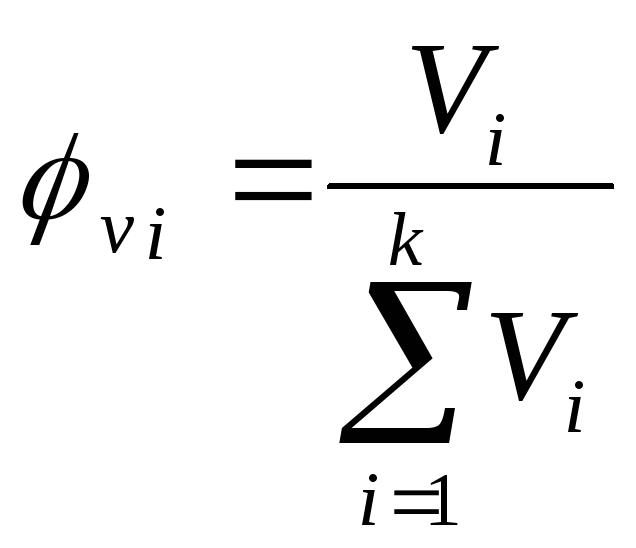 и массовые, или весовые
и массовые, или весовые
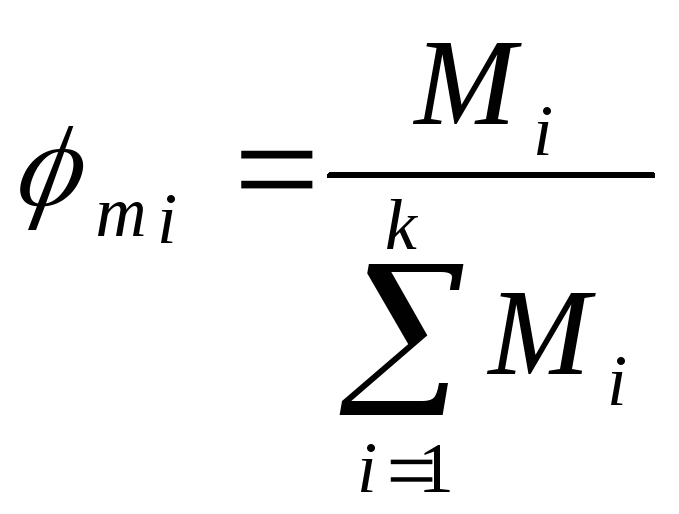 )
доли. При использовании в качестве
переменных состава системы мольных или
удельных долей число независимых
переменных состава равно k-1,
так как общая сумма любых долей равна
единице:
)
доли. При использовании в качестве
переменных состава системы мольных или
удельных долей число независимых
переменных состава равно k-1,
так как общая сумма любых долей равна
единице:
![]() .
При наличии в системе градиентов
полей (сил, напряжений или напряженностей)
дополнительные независимые переменные
выбираются из условий удобства расчетов
из сопряженных пар параметров: сила,
напряжение или напряженность (интенсивная
величина) – реакция на них (экстенсивная
величина), т.е., соответственно,
механическая сила или напряжение (F
или σ) – деформация (Δl
или λ),напряженность электрического
поля Е – электрическая индукция D,
или поляризация Р, диэлектрическая
проницаемость ε или восприимчивость χ
в диэлектриках, напряженность магнитного
поля Н – магнитная индукция В
или намагниченность М (магнитная
восприимчивость μ) в магнитных системах.
При действии в системе гравитационной
или центробежной силы и электрического
поля в качестве дополнительных интенсивных
независимых переменных используются
также потенциалы полей тяготения или
центробежной силы и электрического
поля.
.
При наличии в системе градиентов
полей (сил, напряжений или напряженностей)
дополнительные независимые переменные
выбираются из условий удобства расчетов
из сопряженных пар параметров: сила,
напряжение или напряженность (интенсивная
величина) – реакция на них (экстенсивная
величина), т.е., соответственно,
механическая сила или напряжение (F
или σ) – деформация (Δl
или λ),напряженность электрического
поля Е – электрическая индукция D,
или поляризация Р, диэлектрическая
проницаемость ε или восприимчивость χ
в диэлектриках, напряженность магнитного
поля Н – магнитная индукция В
или намагниченность М (магнитная
восприимчивость μ) в магнитных системах.
При действии в системе гравитационной
или центробежной силы и электрического
поля в качестве дополнительных интенсивных
независимых переменных используются
также потенциалы полей тяготения или
центробежной силы и электрического
поля.
Отношения экстенсивных величин к числу
молей компонентов характеризуют их
средние и парциальные мольные величины,
широко используемые в термодинамике,
особенно применительно к многокомпонентным
системам. Если обозначить Z
как обобщенную экстенсивную величину,
то для многокомпонентной системы
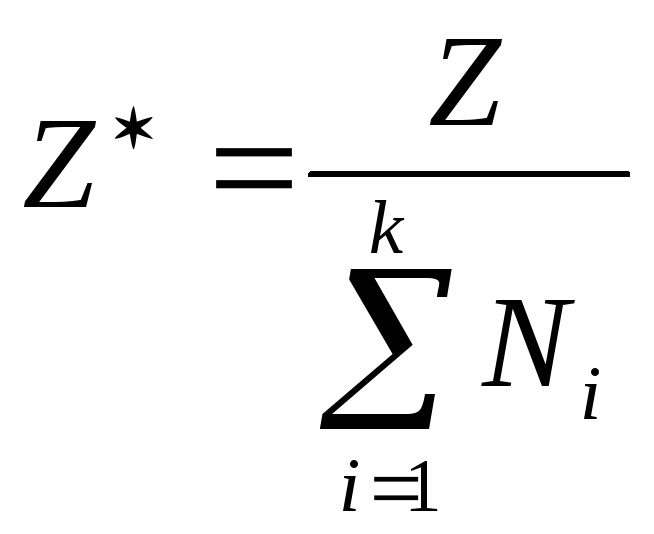 является ее средней мольной величиной,
а
является ее средней мольной величиной,
а
![]() - парциальной мольной величиной.
При этом
- парциальной мольной величиной.
При этом
![]() .
Для однокомпонентных систем Z*
и z представляют собой
просто мольные значения экстенсивной
величины.
.
Для однокомпонентных систем Z*
и z представляют собой
просто мольные значения экстенсивной
величины.
Значения Z, приходящиеся на единицу объема или массы одно- или многокомпонентной системы (удельная объемная и массовая величина - z*v и z*m соответственно), также используются в термодинамике, хотя и реже, чем мольные величины, и характеризуют удельные величины, или плотности экстенсивных величин. При этом важно отметить (в отличие от достаточно широко принятых в учебниках представлений), что парциальные мольные и удельные значения экстенсивных величин, хотя и не зависят от размера системы, не являются интенсивными параметрами, так как они не удовлетворяют второму условию их определения - в условиях равновесия они могут иметь неодинаковые значения в разных частях (фазах) гетерофазной системы. Далее будет показано, что исключение составляет химический потенциал μi, который формально определяется как парциальная мольная свободная энергия Гиббса и совпадает с мольной свободной энергией Гиббса в случае однокомпонентных систем. Химический потенциал является интенсивной величиной, так как он не только не зависит от размеров системы, но и в условиях термодинамического равновесия одинаков во всех ее частях (фазах). Это обусловлено тем, что химический потенциал в многокомпонентных в гетерогенных системах, имеет более общее значение, чем как парциальная мольная свободная энергия Гиббса, так как он выводится в результате преобразования фундаментального уравнения термодинамики (фундаментального уравнения Гиббса).
Далее коротко даны общие представления об основных функциях состояния и основных соотношениях, связывающих их с независимыми переменными (температурой, объемом, давлением, числом молей при отсутствии внешних сил).
