
Электронные спектры поглощения.
1. Основные положения теории электронных спектров поглощения.
Поглощение молекул в ультрафиолетовой и видимой областях спектра обусловлено возбуждением электронов валентной оболочки. В молекулах органических соединении принято различать три типа валентных электронов: -, - и n-электроны. -электроны описываются волновыми функциями, симметричными относительно оси связи, а -электроны–функциями, обращающимися в нуль на оси связи. Волновые функции - и -электронов могут быть связывающими и разрыхляющими (уменьшающими энергию связи между атомами). n-электроны локализованы на отдельных атомах и не участвуют в образовании связи. Состояния электронов, соответствующие разрыхляющим орбиталям обозначают соответствующей буквой со звездочкой (например, *, *).
С точки зрения квантово механической теории, электронные спектры поглощения обусловлены переходами между энергетическими уровнями молекулы. Энергия молекулы, находящейся в определенном электронном состоянии, приближенно может быть представлена суммой энергий отдельных электронов, а волновая функция молекулы в каждом состоянии – произведением одноэлектронных волновых функций. Принято считать, что при возбуждении меняется состояние (энергия и волновая функция) только одного электрона. В связи с этим электронные переходы обычно обозначают символами, соответствующими исходному и конечному состояниям электрона (например, *,*. п*, п*).
Положение полосы в спектре (длина волны, частота или волновое число) определяется разностью энергии конечного и исходного электронных уровней и в значительной степени зависит от типа электронного перехода. Электронные полосы, обусловленные *-переходами находятся в далекой ультрафиолетовой области спектра; n*- и *- переходам соответствуют полосы в средней УФ- области; при сопряжении кратных связей полосы, обусловленные n*- и *-переходами, смещаются в ближнюю ультрафиолетовую и видимую области спектра.
Таким образом, исследуя спектры поглощения в средне и ближней ультрафиолетовой и видимой областях спектра, можно получить сведения о свойства n- и -электронов.
Каждое электронное состояние молекулы характеризуется некоторым интервалом значений энергии, обусловленным главным образом колебательным движением молекулы n межмолекулярными взаимодействиями. Поэтому каждому электронному переходу в спектре соответствует широкий участок поглощения. Распределение интенсивности в пределах этого участка характеризует форму полосы поглощения. Простые молекулы в парах имеют полосы с явно выраженной колебательной структурой и состоят из ряда отдельных узких полос. При переходе к растворам и при усложнении молекул колебательная структура постепенно сглаживается и полосы сложных молекул, являясь сплошными, имеют обычно вид гауссовой кривой ошибок.
Н аряду
с положением в спектре важной
характеристикой полосы является
вероятность соответствующего перехода.
Наиболее распространено использование
в качестве меры вероятности максимального
значения коэффициента экстинкции в
пределах полосы. Учитывая, что важную
роль играет форма полосы, более строгой
мерой вероятности перехода является
интегральная интенсивность A,
выражаемая формулами
аряду
с положением в спектре важной
характеристикой полосы является
вероятность соответствующего перехода.
Наиболее распространено использование
в качестве меры вероятности максимального
значения коэффициента экстинкции в
пределах полосы. Учитывая, что важную
роль играет форма полосы, более строгой
мерой вероятности перехода является
интегральная интенсивность A,
выражаемая формулами
г де
–значение
коэффициента экстинкции 1
и 2
или 1
и 2-
координаты начала и конца полосы.
де
–значение
коэффициента экстинкции 1
и 2
или 1
и 2-
координаты начала и конца полосы.
Если в спектре имеется несколько малоперекрывающих полос, обычно в качестве переделов интегрирования выбирают длины волн минимального поглощения между полосами. В случае сильного перекрывания применяют специальные разделения полос.
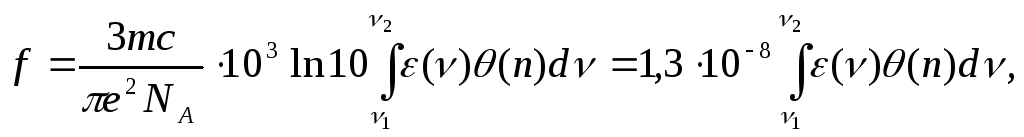 Вероятность
перехода часто характеризуют силой
осциллятора, которая определяется
формулой:
Вероятность
перехода часто характеризуют силой
осциллятора, которая определяется
формулой:
г![]() де
(n)-
поправка на влияние растворителя для
разбавленных растворов, равная:
де
(n)-
поправка на влияние растворителя для
разбавленных растворов, равная:
где n- показатель преломления растворителя.
Сила осциллятора представляет собой отношение вероятности перехода в реальной молекуле к вероятности, соответствующей модели классического затухающего осциллятора данной частоты, и может быть выражена как отношение усредненной величины осциллирующего заряда в молекуле к заряду одного электрона.
Квантово
– механическая теория дает возможность
связать силу осциллятора с величиной
матричного элемента перехода Mik,
который определяется волновыми функциями
исходного и конечного состояний (k
и i)
и оператором момента перехода (![]() ):
):
Д![]()
![]() ля
разрешенных переходов сила осциллятора
обычно лежит в интервале от сотых до
нескольких единиц, для запрещенных
– ее
значение 10-3.
ля
разрешенных переходов сила осциллятора
обычно лежит в интервале от сотых до
нескольких единиц, для запрещенных
– ее
значение 10-3.
Полосы поглощения в близкой и средней ультрафиолетовой областях спектра определяется, как уже говорилось, переходами - и n-электронов. Группы, содержащие такие электроны (кратные связи и атомы с неподеленными электронными парами), обусловливающие поглощение вещества, называются хромофорами. Как правило, соединения, содержащие один и тот же хромофор, имеют полосы с близкими значениями длины волны максимума и коэффициента экстинкции. Поэтому, сравнивая спектр поглощения соединения с таблицами хромофоров, можно получить информацию о присутствии соответствующих функциональных групп в исследуемой молекуле.
Если в молекуле два или несколько хромофоров разделены двумя н более простыми связями, ее спектр представляет собой наложение полос всех имеющихся хромофоров. Но если хромофоры разделены только одной простой связью, - и n-электроны соседних групп вступают во взаимодействие и спектр сильно меняется. Можно сказать, что в этом случае возникает новая хромофорная группа. Так, при сопряжении кратных связей полоса смещается в длинноволновую сторону (в среднем на 30 нм при добавлении к сопряженной системе одной кратной связи), а ее интенсивность увеличивается.
Если в молекуле присутствуют группы–доноры и акцепторы электрона, то под влиянием излучения может происходить перенос заряда от донора к акцептору. Это так называемые переходы с внутримолекулярным переносом заряда (ВПЗ).
Аналогичным образом излучение может вызывать перенос заряда от одной молекулы к другой – межмолекулярный перенос заряда (МПЗ). Этот процесс наиболее вероятен при образовании слабых комплексов донорно-акцепторного типа. Изучение интенсивности такой полосы даст возможность определить состав и оценить константу равновесия комплекса.
Электронные спектры поглощения сильно подвержены влиянию растворителей. При переходе молекулы из парообразного состояния в раствор ее энергетические уровни понижаются за счет межмолекулярных взаимодействий вандерваальсовского характера. Поскольку при оптических переходах меняется электронное строение молекулы, понижение основного и возбужденного уровней молекулы за счет взаимодействия с растворителем неодинаково, что приводит к смещению полос поглощения при переходе от паров к растворам. Этот факт дает возможность по смещению полос поглощения молекулы в разных растворителях определять изменения ее электронной структуры, происходящие при возбуждении.
Спектры поглощения молекул с функциональными группами кислотного и основного характера обычно зависят от рh среды. На этом факте основаны спектрофотометрические методы определения констант диссоциации кислот и оснований.
Электронная абсорбционная спектроскопия широко используется также и в количественном анализе. Единственным условием ее применения является выполнение для исследуемых растворов закона Бугера–Ламберта–Бера – линейной зависимости между оптической плотностью и концентрацией вещества в растворе.
Характеристичным по частоте называется такое нормальное колебание, частота которого сохраняется в пределах широкого ряда молекул, содержащих данную группировку. Экспериментально найдено, что характеристичными по частоте являются колебания многих групп атомов и, в частности, группировок С = 0, С–Н, 0–Н и др. Одна и та же группировка может характеризоваться несколькими частотами, например группа СН3- частотами симметричного и антисимметричного валентных колебаний ч нескольких типов деформационных. Именно характеристичность колебаний по частоте служит основой широкого использования колебательной спектроскопии как метода анализа в практике спектрохимических исследований.
Выше уже отмечалось, что в ИК - спектрах многоатомных молекул может проявляться лишь часть всех 3N–6 основных колебаний. Прежде всего это обусловлено тем, что активными в ИК - спектрах являются только те колебания, которые сопровождаются изменением электрического дипольного момента молекулы . Основное колебание будет активно в ИК - спектре при условии отличия от нуля
первой
производной дипольного момента по
нормальной координате, т.е.
![]() .
Соответственно, первый обертон проявляется
при условии
.
Соответственно, первый обертон проявляется
при условии
![]() ,
второй обертон
– при
,
второй обертон
– при
![]() и т.д.
и т.д.
Кроме того, в симметричных молекулах, обладающих осью симметрии не ниже 3-го порядка, различные колебания могут иметь одинаковые частоты (быть вырожденными). В результате вырождения колебаний в ИК - спектрах этих молекул сокращается число полос. В отдельных случаях уменьшение числа полос в ИК - спектрах происходит за счет случайного совпадения частот.
В настоящее время ИК - спектры молекул широко применяются в основном для идентификации соединений, в количественном н структурно-групповом анализе для изучения внутри- и межмолекулярных взаимодействий.
