
- •Вступ. Фізика як наука. План
- •1. Зародження і розвиток фізики як науки.
- •2. Роль фізичного знання в житті людини й розвитку суспільства.
- •3. Методи наукового пізнання.
- •Механічний рух. Система відліку. Відносність руху. Матеріальна точка. Траєкторія. Шлях і переміщення. Швидкість. Додавання швидкостей. Рівномірний прямолінійний рух.
- •1. Механічний рух. Система відліку. Відносність руху. Матеріальна точка. Траєкторія. Шлях і переміщення.
- •3. Рівномірний прямолінійний рух. Графіки залежності кінематичних величин від часу.
- •Запитання для самоперевірки
- •Прискорення. Рівноприскорений прямолінійний рух. Графіки залежності кінематичних величин від часу. План
- •1. Прискорення. Рівноприскорений прямолінійний рух.
- •Запитання для самоперевірки
- •Рівномірний рух по колу. Період і частота обертання. Лінійна і кутова швидкості. Доцентрове прискорення. План
- •1. Рівномірний рух по колу. Період і частота обертання. Лінійна і кутова швидкості.
- •2. Доцентрове прискорення.
- •Запитання для самоперевірки
- •Перший закон Ньютона. Інерціальні системи відліку. Принцип відносності Галілея. План
- •1. Інерція та інертність.
- •2. Інерціальні системи відліку. Принцип відносності Галілея.
- •3. Перший закон Ньютона.
- •Запитання для самоперевірки
- •Маса. Сила. Додавання сил. Другий закон Ньютона. Третій закон Ньютона. План
- •1. Маса.
- •2. Сила. Додавання сил.
- •3. Другий закон Ньютона.
- •4. Третій закон Ньютона.
- •Запитання для самоперевірки
- •Гравітаційні сили. Закон всесвітнього тяжіння. Сила тяжіння. Рух під дією сили тяжіння. План
- •1. Гравітаційні сили. Закон всесвітнього тяжіння.
- •2. Сила тяжіння. Рух під дією сили тяжіння.
- •Запитання до самоперевірки
- •Вага тіла. Невагомість. Рух штучних супутників Землі. Перша космічна швидкість. План
- •1. Вага тіла.
- •2. Невагомість.
- •3. Рух штучних супутників Землі. Перша космічна швидкість.
- •Запитання для самоперевірки
- •Сила пружності. Закон Гука. Сила тертя. Коефіцієнт тертя. План
- •1. Сила пружності. Закон Гука.
- •2. Сила тертя. Коефіцієнт тертя.
- •Запитання для самоперевірки
- •Момент сили. Умови рівноваги тіла. Важель. План
- •1. Статика. Умови рівноваги тіла.
- •2. Момент сили.
- •Запитання до самоперевірки
- •Імпульс (кількість руху) тіла. Закон збереження імпульсу. Реактивний Рух. План
- •1. Імпульс (кількість руху) тіла. Закон збереження імпульсу.
- •2. Реактивний Рух.
- •Запитання для самоперевірки
- •Механічна робота. Потужність. Кінетична і потенціальна енергія. Закон збереження енергії в механіці. Коефіцієнт корисної дії простих механізмів. План
- •1. Механічна робота. 000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000000
- •2. Потужність.
- •3. Механічна енергія. Закон збереження енергії в механіці. Коефіцієнт корисної дії простих механізмів.
- •Запитання для самоперевірки
- •Основні положення молекулярно-кінетичної теорії та її дослідне обґрунтування. Маса та розмір молекул. Стала Авогадро. План
- •1. Основні положення молекулярно-кінетичної теорії та її дослідне обґрунтування.
- •2. Маса та розмір молекул. Стала Авогадро.
- •Запитання для самоперевірки
- •1. Взаємодія атомів і молекул у газах, рідинах і твердих тілах.
- •2. Температура та її вимірювання. Абсолютна температурна шкала. Закон Дальтона.
- •3. Швидкість молекул газу. Дослід Штерна.
- •Запитання для самоперевірки
- •Ідеальний газ. Основне рівняння молекулярно-кінетичної теорії ідеального газу. План
- •1. Ідеальний газ.
- •2. Основне рівняння молекулярно-кінетичної теорії ідеального газу.
- •Запитання для самоперевірки
- •Рівняння стану ідеального газу (рівняння Клапейрона - Менделєєва). Ізопроцеси в газах. План
- •1. Рівняння стану ідеального газу.
- •2. Ізопроцеси в газах.
- •Запитання для самоперевірки
- •Пароутворення (випаровування та кипіння). Конденсація. Питома теплота пароутворення. Насичена і ненасичена пара, їх властивості. План
- •1. Пароутворення (випаровування та кипіння). Конденсація.
- •2. Питома теплота пароутворення.
- •3. Насичена і ненасичена пара, їх властивості.
- •Запитання для самоперевірки
- •Вологість повітря та її вимірювання. План
- •1. Вологість повітря.
- •2. Точка роси. Вимірювання вологості повітря.
- •Запитання для самоперевірки
- •Поверхневий натяг рідин. Сила поверхневого натягу. Змочування. Капілярні явища. План
- •1. Поверхневий натяг рідин. Сила поверхневого натягу.
- •2. Змочування.
- •3. Капілярні явища.
- •Запитання для самоперевірки
- •Кристалічні та аморфні тіла. Механічні властивості твердих тіл. Види деформацій. Модуль Юнга. План
- •Запитання для самоперевірки
- •1. Плавлення і тверднення тіл. Питома теплота плавлення.
- •2. Згоряння. Питома теплота згоряння палива.
- •3. Рівняння теплового балансу.
- •Запитання для самоперевірки
- •Теплове розширення тіл. План
- •1. Теплове розширення твердих тіл, рідин і газів
- •2. Причини теплового розширення.
- •3. Характеризуємо теплове розширення твердих тіл.
- •4. Теплове розширення у природі й техніці.
- •Тепловий рух. Внутрішня енергія тіла і способи її зміни. Кількість теплоти. Питома теплоємність речовини. Робота в термодинаміці. План
- •1. Внутрішня енергія тіла і способи її зміни.
- •2. Кількість теплоти. Питома теплоємність речовини.
- •3. Робота в термодинаміці.
- •Запитання для самоперевірки
- •Закон збереження енергії в теплових процесах (перший закон термодинаміки). Застосування першого закону термодинаміки до ізопроцесів. Адіабатний процес. План
- •1. Закон збереження енергії в теплових процесах (перший закон термодинаміки).
- •2. Застосування першого закону термодинаміки до ізопроцесів. Адіабатний процес.
- •1. Необоротність теплових процесів.
- •2. Принцип дії теплових двигунів. Цикл Карно.
- •3. Коефіцієнт корисної дії теплового двигуна і його максимальне значення.
- •4. Теплові двигуни і проблеми охорони навколишнього середовища.
- •Запитання для самоперевірки
Основні положення молекулярно-кінетичної теорії та її дослідне обґрунтування. Маса та розмір молекул. Стала Авогадро. План
1. Основні положення молекулярно-кінетичної теорії та її дослідне обґрунтування.
2. Маса та розмір молекул. Стала Авогадро.
1. Основні положення молекулярно-кінетичної теорії та її дослідне обґрунтування.
Молекулярна фізика вивчає тепловий рух. Тепловий рух зумовлює внутрішні властивості тіл, і його вивчення дає змогу зрозуміти багато фізичних процесів, які відбуваються в тілах.
Явища, зумовлені тепловим рухом атомів і молекул, називають тепловими. Вони відіграють важливу роль у природі. Зі зміною температури повітря змінюється все - температура тіла, розміри твердих тіл і рідин.
Молекулярно-кінетична теорія пояснює теплові явища в макроскопічних тілах на основі уявлень, що всі тіла складаються з окремих частинок, які рухаються хаотично.
Теорію, яка пояснює будову і властивості тіл на основі закономірностей руху і взаємодії молекул, називають молекулярно-кінетичною теорією. Значний внесок у створення МКТ зробили: Лавуаз'є, Ломоносов, Больцман (друга половина ХІХ ст.).
Основні положення МКТ речовини:
1. Будь-які речовини мають дискретну (переривчасту) будову. Вони складаються з найдрібніших частинок молекул і атомів. Підтвердженням дискретності є прокатка, кування металу, отримання 1974 року фотографії окремих молекул і атомів, розчинність речовин тощо.
Молекули - найменші частинки, які мають хімічні властивості речовини. Молекули складаються з більш простих частинок - атомів хімічних елементів. У природі є 92 хімічні елементи. Разом із штучними наразі налічується 105 елементів.
Речовину, яка побудована з атомів лише одного виду, називають елементом (водень, кисень, азот тощо). Кожен елемент має свій номер Z в таблиці Менделєєва. Число Z визначає кількість протонів у ядрах атомів і електронів, що рухаються в атомі навколо ядра.
2. Молекули знаходяться в стані неперервного хаотичного (невпорядкованого) руху, що називається тепловим і у загальному випадку є сукупністю поступального, обертального і коливального рухів.
Під час нагрівання речовини швидкість теплового руху і кінетична енергія його частинок збільшуються, а під час охолодження зменшуються. Ступінь нагрітості тіла характеризує його температура, яка є мірою середньої кінетичної енергії хаотичного поступального руху молекул цього тіла.
3. Молекули взаємодіють одна з одною із силами електромагнітної природи, причому на великих відстанях вони притягуються, а на малих - відштовхуються. Сили притягання і відштовхування між молекулами діють постійно.
Молекули різних речовин по-різному взаємодіють одна з одною. Ця взаємодія залежить від типу молекул і відстані між ними. Залежно від характеру руху і взаємодії молекул розрізняють три стани речовини: твердий, рідкий, газоподібний (плазма).
Плазма - сильно іонізований газ (повітря), під дією високих температур. Для газів характерні великі міжмолекулярні відстані, малі сили притягання, тому гази можуть необмежено розширюватись. Молекули газу хаотично рухаються, співударяються одна з одною і зі стінками посудини (рис.3.1.3).
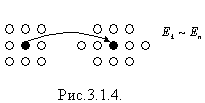
У рідинах молекули розміщені тісно і коливаються навколо положення рівноваги, а також перескакують з одного рівноважного положення в інше (ближній порядок) (рис. 3.1.4).
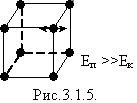
У твердих тілах сили взаємодії кожної молекули із сусідніми настільки великі, що молекула здійснює малі коливання навколо деякого сталого положення рівноваги - вузла кристалічних грат - дальній порядок (рис.3.1.5).
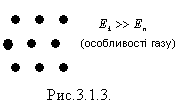
Молекулярно-кінетичну теорію речовини підтверджено такими дослідами і спостереженнями:
- дослід із змішуванням рідин;
- дослід із розчиненням твердих речовин в рідинах;
- спостереження над стисливістю речовин;
- деформації твердих тіл;
- броунівський рух;
- спостереження дифузії;
- зображення окремих молекул, отримані за допомогою іонного проектора, електронного мікроскопа;
- рентгеноструктурний аналіз речовин;
- спостереження осмосу.
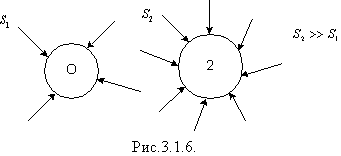
Броун 1827 року відкрив хаотичний рух спори плауна у воді. Рух завислих частинок відбувався внаслідок руху молекул. Такого ж руху зазнають частинки фарби у воді, пилинки в промені світла тощо. Молекули передають частинкам імпульс, а отже, чинять на частинки тиск. Якщо частинка має малу площу S1, то на одну з її сторін у будь-який момент часу середнє значення тиску може бути більшим, ніж на іншу, тому частинка здійснює безладний рух в об'ємі рідини. Причиною броунівського руху є флуктуація імпульсу, що передається від молекул частинці. Флуктуація - відхилення значення будь-якої величини від середнього. Оскільки S2 >> S1, частинка 2 не здійснює броунівського руху, бо тиск з усіх боків на неї однаковий (рис.3.1.6). 1905 року Ейнштейн розробив кількісну теорію броунівського руху.
Дифузія - явище спонтанного проникнення молекул контактуючих речовин в міжмолекулярні проміжки кожної з них.
Дифузію, що відбувається через напівпроникні перегородки, називають осмосом.
Приклад дифузії в газах - виникнення запаху, у рідинах - переміщування рідин різної густини. Молекули золота і свинцю внаслідок дифузії протягом 5 років утворюють шар завтовшки 1 см.
З підвищенням температури швидкість дифузії зростає. У природі дифузія сприяє живленню рослин з ґрунту. Без дифузії життя було б неможливим, адже насичення крові киснем і відведення шкідливих речовин - теж дифузія.
Довести існування значних сил притягання між атомами або молекулами можна, зокрема, за допомогою досліду з товстою палицею, яку важко зламати. Але одні лише сили притягання не можуть забезпечити існування стійких атомів й молекул.
Завдяки силам відштовхування молекули не проникають одна в одну.
Хоч молекули електронейтральні, між ними на малих відстанях діють значні електричні сили, бо молекула - складна система, що складається з електронів і ядер атомів. Відбувається взаємодія між електронами і ядрами сусідніх молекул.
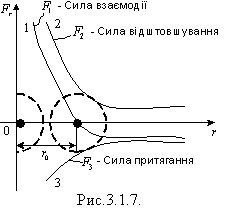
Електричне поле за межами молекул швидко спадає з відстанню. Якщо зблизити молекули на відстань 2 - 3 діаметрів, виникає взаємодія їх ядер і електронних оболонок. Різнойменні заряди починають притягатися, а однойменні відштовхуватися. Коли молекули зіткнуться своїми електронними оболонками подальше їх зближення стає неможливим. Сили відштовхування різко зростають зі зменшенням відстані між центрами молекул. Якщо r > r0, тоді переважають сили відштовхування і навпаки.
Графічну залежність сили взаємодії Fr (1), сили відштовхування F1 (2) і сили притягання F2 (3) молекул від відстані між молекулами зображено на рис.3.1.7.
 Більшість
молекул неорганічних речовин мають
діаметр
Більшість
молекул неорганічних речовин мають
діаметр
d ![]() 10-10 м
і m = 10-26 кг. Гігантами є
молекули білків. Характерний розмір
молекули дезоксирибонуклеїнової кислоти
(ДНК), наприклад, досягає кількох
сантиметрів.
10-10 м
і m = 10-26 кг. Гігантами є
молекули білків. Характерний розмір
молекули дезоксирибонуклеїнової кислоти
(ДНК), наприклад, досягає кількох
сантиметрів.
