
- •Кислотно-основное титрование
- •Контрольные вопросы
- •Лабораторная работа № 1. Приготовление рабочего раствора соляной кислоты
- •Посуда и реактивы
- •Ход работы
- •Методика определения плотности с помощью пикнометра
- •Методика определения плотности с помощью ареометра
- •Лабораторная работа № 2 Приготовление стандартного раствора тетрабората натрия
- •Посуда и реактивы
- •Ход работы
- •Взятие навески методом присыпания
- •Взятие навески методом отсыпания
- •Ход работы Установление титра и молярной концентрации раствора соляной кислоты методом пипетирования.
- •Установление титра и молярной концентрации раствора соляной кислоты методом отдельных навесок
- •Ход работы
- •Лабораторная работа №5 Определение содержания NaOh и Na2co3 в растворе при их совместном присутствии
- •Посуда и реактивы
- •Ход работы
- •Комплексонометрическое титрование
- •Контрольные вопросы
- •Лабораторная работа №6 Установление титра и молярной концентрации эквивалента рабочего раствора комплексона III
- •Посуда и реактивы
- •Ход работы
- •Лабораторная работа №7 Определение общей жесткости воды методом комплексонометрического титрования
- •Посуда и реактивы
- •Ход работы
- •Лабораторная работа №8 Определение содержания ионов кальция и магния при их совместном присутствии в растворе
- •Посуда и реактивы
- •Ход работы
- •Окислительно-восстановительное (редоксиметрическое) титрование
- •Контрольные вопросы
- •Лабораторная работа №10
- •Установка титра методом отдельных навесок
- •Лабораторная работа №11
- •Перманганатометрическим методом.
- •Посуда и реактивы
- •Лабораторная работа №12 Определение содержания пероксида водорода в растворе
- •Посуда и реактивы
- •Лабораторная работа №13
- •Бихроматометрическим методом
- •Посуда и реактивы
- •Приготовление стандартного раствора бихромата калия
- •Приготовление контрольного раствора соли Мора
- •Литература.
- •Методические указания
- •Ротапринт ТюмГнгу, 625036, Тюмень, Володарского 38
Ход работы
На аналитических весах берут точную навеску NaOH в пределах 0,4 г; количественно переносят ее в мерную колбу емкостью 100 мл; растворяют в дистиллированной воде, свободной от CO2, т.е. прокипяченной и охлажденной в сосуде, имеющем поглотительную трубку с натронной известью; доводят объем до кольцевой отметки и тщательно перемешивают, предварительно закрыв колбу пробкой.
Бюретку для титрования промывают и заполняют 0,1М раствором HCl. Уровень жидкости в бюретке устанавливают на нулевом делении шкалы по нижнему мениску на уровне глаз.
Пипеткой Мора отбирают аликвотную часть контрольного раствора смеси NaOH и Na2CO3, быстро переносят в колбу для титрования, добавляют 4-5 капель фенолфталеина (меньшее количество индикатора обесцвечивается до достижения точки эквивалентности под действием CO2 воздуха) и тот час же приступают к титрованию, избегая сильного перемешивания, которое усиливает поглощение CO2 из воздуха.
Титрование проводят до обесцвечивания раствора от одной избыточной капли титранта. По шкале бюретки фиксируют объем HCl (V1), израсходованный на титрование с фенолфталеином.
Затем в колбу для титрования добавляют 1-2 капли индикатора метилового оранжевого. Раствор окрашивается в желтый цвет. Не доливая кислоту в бюретку, продолжают титровать до появления оранжевой окраски, устойчивой в течение 1 минуты. По шкале бюретки фиксируют общий объем HCl (V2), израсходованный на титрование с двумя индикаторами: фенолфталеином и метиловым оранжевым.
Титрование проводят несколько раз до получения трех сходящихся результатов.
Содержание NaOH и Na2CO3 в контрольном растворе рассчитывают по формулам:

![]()
где C(HCl)- молярная концентрация раствора HCl, моль/л;
V1-объем раствора HCl, израсходованный на титрование с фенолфта-
леином, мл;
V2- объем раствора HCl, израсходованный на титрование с фенолфта-
леином и метиловым оранжевым, мл;
M(HCl)- молярная масса HCl, г/моль;
М(![]() Na2CO3)-
молярная масса эквивалента Na2CO3,
г/моль экв.;
Na2CO3)-
молярная масса эквивалента Na2CO3,
г/моль экв.;
Vобщ.- общий объем контрольного раствора, мл;
Vал- объем аликвоты контрольного раствора, мл.
Рассчитывают процентное содержание NaOH и Na2CO3 в образце.
Проводят статистическую обработку результатов анализа.
Комплексонометрическое титрование
Комплексонометрическое титрование- это метод анализа, основанный на реакциях образования комплексных соединений катионов металлов с органическими реактивами, называемыми комплексонами.
Комплексоны представляют собой производные аминополикарбоновых кислот. На практике наиболее часто используются:
комплексон I – нитрилотриуксусная кислота



![]()
 H3Y
H3Y
комплексон II – этилендиаминтетрауксусная кислота (сокращенно ЭДТА)





![]()
 H4Y
H4Y
комплексон III – двунатриевая соль этилендиаминтетрауксусной кислоты
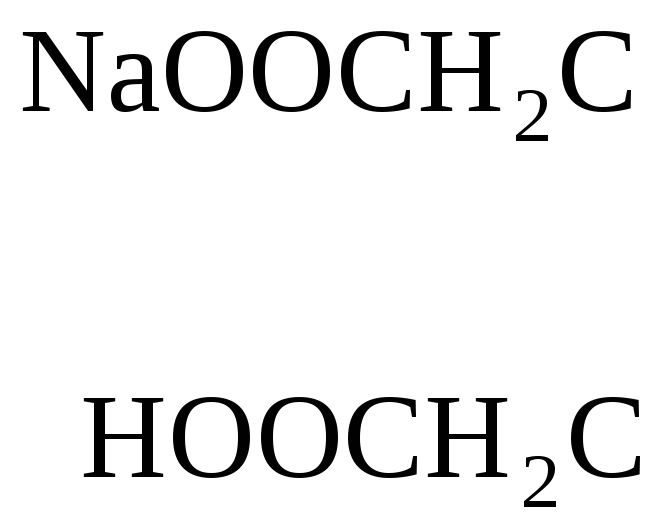




![]()
 Na2H2Y
Na2H2Y
Комплексоны образуют со многими катионами комплексные соединения циклического характера (хелаты), называемые еще внутрикомплексными солями.
Реакции взаимодействия катионов с комплексоном III могут быть представлены в следующем виде:
Na2H2Y ––– 2Na++H2Y2-
Mg2++H2Y2-
![]() MgY2-+
2H+
MgY2-+
2H+
Fe3++H2Y2-
![]() FeY-+
2H+
FeY-+
2H+
Zr4++H2Y2-
![]() ZrY+ 2H+
ZrY+ 2H+
Реакции комплексообразования протекают стехиометрически, т.е. в строго эквивалентных количествах, и поэтому могут быть использованы для количественного определения многих катионов.
При комплексообразовании независимо от заряда катиона всегда выделяются два иона водорода. Поэтому молярная масса эквивалента определяемого катиона равна половине его атомной массы, а молярная масса эквивалента титранта – половине его молярной массе. Для комплексона III:
![]()
В процессе комплексообразования pH раствора понижается, что может привести к разрушению образовавшегося комплексного соединения. Во избежание этого комплексонометрическое титрование проводят при постоянном значении pH в присутствии соответствующего буфера (формиатного, ацетатного, уротропинового, аммонийного и др.)
В зависимости от величины константы устойчивости титрование проводят при различных значениях pH. Некоторые комплексы, например, Ba2+, Sr2+, Mg2+, Ca2+, сравнительно малоустойчивы; их можно титровать только в щелочной среде. Ионы, образующие более прочные комплексы (Co2+, Cd2+, Zn2+, Pb2+, N12+) можно титровать в умеренно кислой среде, а трех-четырех разрядные ионы (Fe3+, V3+, Th4+, Zr4+)- даже в сильно кислой среде.
В методе комплексонометрического титрования точку эквивалентности устанавливают с помощью металл–индикаторов. Металл–индикаторы представляют собой органические соединения, образующие с ионами металлов интенсивно окрашенные комплексы. Общее число металл-индикаторов достаточно велико, но наиболее часто используют следующие: кислотный хромоген черный специальный (или эриохром черный Т), мурексид, ксиленоловый оранжевый, пирокатехиновый фиолетовый, пирогалловый красный, дитизон, арсеназо и др.
Метод комплексонометрического титрования универсален и применим для анализа широкого круга разнообразных объектов: катионов, их смесей, анионов, органических соединений. С помощью комплексонов может быть определенно около 60 элементов, в т.ч. катионы щелочноземельных металлов, которые трудно или невозможно перевести в комплексные соединения другими способами.
