
- •Кислотно-основное титрование
- •Контрольные вопросы
- •Лабораторная работа № 1. Приготовление рабочего раствора соляной кислоты
- •Посуда и реактивы
- •Ход работы
- •Методика определения плотности с помощью пикнометра
- •Методика определения плотности с помощью ареометра
- •Лабораторная работа № 2 Приготовление стандартного раствора тетрабората натрия
- •Посуда и реактивы
- •Ход работы
- •Взятие навески методом присыпания
- •Взятие навески методом отсыпания
- •Ход работы Установление титра и молярной концентрации раствора соляной кислоты методом пипетирования.
- •Установление титра и молярной концентрации раствора соляной кислоты методом отдельных навесок
- •Ход работы
- •Лабораторная работа №5 Определение содержания NaOh и Na2co3 в растворе при их совместном присутствии
- •Посуда и реактивы
- •Ход работы
- •Комплексонометрическое титрование
- •Контрольные вопросы
- •Лабораторная работа №6 Установление титра и молярной концентрации эквивалента рабочего раствора комплексона III
- •Посуда и реактивы
- •Ход работы
- •Лабораторная работа №7 Определение общей жесткости воды методом комплексонометрического титрования
- •Посуда и реактивы
- •Ход работы
- •Лабораторная работа №8 Определение содержания ионов кальция и магния при их совместном присутствии в растворе
- •Посуда и реактивы
- •Ход работы
- •Окислительно-восстановительное (редоксиметрическое) титрование
- •Контрольные вопросы
- •Лабораторная работа №10
- •Установка титра методом отдельных навесок
- •Лабораторная работа №11
- •Перманганатометрическим методом.
- •Посуда и реактивы
- •Лабораторная работа №12 Определение содержания пероксида водорода в растворе
- •Посуда и реактивы
- •Лабораторная работа №13
- •Бихроматометрическим методом
- •Посуда и реактивы
- •Приготовление стандартного раствора бихромата калия
- •Приготовление контрольного раствора соли Мора
- •Литература.
- •Методические указания
- •Ротапринт ТюмГнгу, 625036, Тюмень, Володарского 38
Методика определения плотности с помощью ареометра
А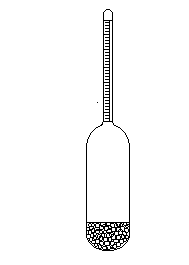 реометр
представляет собой полый, герметически
закрытый цилиндрический стеклянный
сосуд (рис.2). В нижней части ареометра
находится груз (дробь), благодаря чему
ареометр, погруженный в жидкость,
удерживается в вертикальном положении.
К внутренней поверхности верхней узкой
части ареометра прикреплена бумажная
шкала с делениями.
реометр
представляет собой полый, герметически
закрытый цилиндрический стеклянный
сосуд (рис.2). В нижней части ареометра
находится груз (дробь), благодаря чему
ареометр, погруженный в жидкость,
удерживается в вертикальном положении.
К внутренней поверхности верхней узкой
части ареометра прикреплена бумажная
шкала с делениями.
Рис.2. Ареометр
Для определения плотности исследуемый раствор HCl, выдержанный при температуре 200С, наливают в сухой цилиндр емкостью 250 мл. Если кислота дымящаяся, то работу проводят в вытяжном шкафу. В раствор погружают ареометр с соответствующей шкалой. Во избежание излишней потери времени на подбор требуемого ареометра предварительно грубо определяют плотность раствора при помощи менее чувствительного ареометра, имеющего в отличии от других более широкую шкалу измерений (от 1,0 до 1,8 г/см3).
Отсчет показаний проводят по верхнему делению шкалы ареометра, выступающему на уровне поверхности жидкости с точностью до тысячных.
Во время отсчета по шкале ареометр не должен вращаться и касаться стенок и дна цилиндра.
2.По справочной таблице определяют массовую долю (процентную концентрацию) HCl в растворе.
3.Рассчитывают, какой объем концентрированного раствора HCl потребуется для приготовления заданного объема 0,1М раствора HCl.
Пример. Рассчитать, какой объем раствора HCl плотностью 1,179 г/см3 потребуется для приготовления 250,0 мл 0,1М раствора HCl.
Решение: По справочной таблице (Лурье Ю.Ю., 1979, таблица 19В) определяют, что раствор плотностью 1,179 г/см3 имеет процентную концентрацию HCl, равную 36%.
Рассчитывают, сколько граммов HCl потребуется для приготовления
250,0 мл 0,1 м раствора HCl. Для этого составляют пропорцию:
1000 мл – 0,136,5 г HCl
250,0 мл – х г HCl
х =
![]() = 1,83 г HCl
= 1,83 г HCl
M(HCl) = 36,5 г/моль
Рассчитывают, сколько граммов 36%-го раствора HCl потребуется для приготовления 250,0 мл 0,1 раствора HCl. Для этого составляют пропорцию:
100 г раствора – 36,0 г HCl
х г раствора – 1,83 г HCl
x=![]() =5,07
г
=5,07
г
Рассчитывают, какой объем занимают 5,07 г 36%-го раствора HCl.
V=![]() мл
мл
4.Мерной пипеткой отмеряют рассчитанный объем концентрированного раствора HCl; переносят в мерную колбу соответствующей емкости; доводят объем раствора дистиллированной водой до кольцевой метки и тщательно перемешивают, предварительно закрыв колбу пробкой.
Полученный раствор HCl подвергают стандартизации.
Лабораторная работа № 2 Приготовление стандартного раствора тетрабората натрия
Цель работы - ознакомиться с методикой приготовления стандартных рас-
творов по точной навеске вещества.
Посуда и реактивы
Мерная колба емкостью 100 или 250 мл;
стакан емкостью 50 мл;
пробирка с пробкой;
тетраборат натрия Na2B4O710H2O (x.ч.).
Тетраборат натрия используют для стандартизации растворов кислот. Тетраборат натрия как установочное вещество обладает следующими достоинствами:
- не изменяет своего состава при хранении в плотно закрытой склянке в
течение длительного времени;
- имеет высокое значение молярной массы эквивалента:
M(![]() Na2B4O710H2O)=
Na2B4O710H2O)=![]() =190,7
г/моль экв.
=190,7
г/моль экв.
Недостатками тетрабората натрия являются плохая растворимость в воде и легкость, с которой он теряет часть кристаллизационной воды при неправильном хранении, вследствие чего декагидрат превращается в пентагидрат. Если тетраборат натрия не отвечает составу Na2B4O710H2O, то его перед использованием перекристаллизовывают при температуре ниже 600С.
