
- •Образец оформления работы по качественному функциональному анализу
- •1. Реакции непредельных соединений
- •1.1. Тест на растворимость
- •1.2. Реакции ненасыщенных соединений с бромом
- •1.3. Окисление ненасыщенных соединений перманганатом калия
- •1.4. Образование и свойства этилена
- •1.6. Тест на присутствие в ненасыщенном соединении гидропероксидов
- •2. Реакции спиртов
- •2.1. Взамодействие спиртов с натрием
- •2.2. Реакции окисления спиртов
- •Окисление спиртов хромовой кислотой
- •Окисление этанола перманганатом калия
- •2.3. Реакции спиртов с неорганическими кислотами
- •2.3.1. Взаимодействие спиртов с серной кислотой
- •2.3.2. Взаимодействие одноатомных спиртов с борной кислотой
- •Обнаружение пероксидов в простых эфирах
- •3. Реакции вицинальных гликолей (1,2-диолов)
- •3.1. Реакция комплексообразования виц-диолов
- •3.1.1. Взаимодействие виц-диолов с борной кислотой
- •3.1.2. Взаимодействие виц-диолов с гидроксидом меди(II)
- •4. Реакции фенолов
- •4.1. Тест на растворимость фенолов
- •4.2. Комплексообразование фенолов с хлоридом железа(III)
- •4.3. Реакция фенолов с бромом
- •4.4. Реакции окисления фенолов
- •4.4.1. Окисление перманганатом калия
- •4.4.2. Окисление хромовой кислотой
- •5. Реакции диазотирования ароматических аминов
- •5.1. Диазотирование анилина
- •5.2. Образование азокрасителей реакциями азосочетания
- •5.2.1. Азосочетание с аминами
- •5.2.2. Азосочетание с фенолами
- •5.2.3. Окраска ткани азокрасителями
- •6. Реакции карбонильных соединений
- •6.1. Реакции альдегидов и кетонов по карбонильной группе
- •6.1.1. Реакция с 2,4-динитрофенилгидразином
- •6.1.2. Реакция с бисульфитом натрия
- •6.1.3. Реакция с сульфитом натрия
- •6.1.4. Реакция альдегидов с фуксинсернистой кислотой (реакция Шиффа)
- •6.2. Реакции окисления альдегидов
- •6.2.1. Окисление альдегидов хромовой смесью
- •6.2.2. Окисление альдегидов реактивом Фелинга
- •6.3. Реакции енольных форм
- •6.3.1. Образование дибензальацетона
- •6.3.2. Иодоформная проба
- •6.3.3. Реакция устойчивых енольных форм с хлоридом железа(III)
- •7. Реакции окси- и аминокислот
- •7.1. РеакциИ оксикислот с хлоридом железа(III)
- •7.1.1. Реакции алифатических оксикислот с хлоридом железа(III)
- •7.1.2. Реакции оксибензойных кислот с хлоридом железа(III)
- •7.2. РеакциИ коМплексообразования с участием
- •7.2.1. Реакции α-аминокислот с хлоридом железа(III)
- •7.2.2. Реакции α-аминокислот с солями меди(II)
- •7.3. Реакция аминокислот с нингидрином (реакция Руэманна)
- •7.4. Реакция аминокислот с формальдегидом
- •8. Реакции углеводов
- •8.1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •8.2. Реакция Селиванова на кетозы
- •8.3. Взаимодействие сахаров с солями двухвалентной меди в щелочном растворе
- •8.3.1. Доказательство наличия вицинальных гидроксильных групп
- •8.3.2. Окисление восстанавливающих сахаров соединениями двухвалентной меди (реакция Троммера)
- •8.4. Окисление моносахаридов йодом
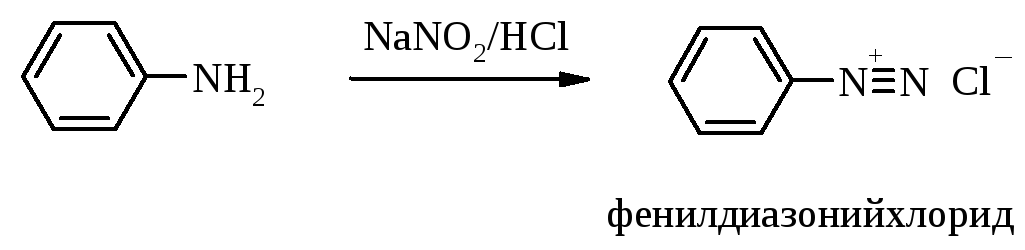
5. Реакции диазотирования ароматических аминов
5.1. Диазотирование анилина
Выполнение работы
-
Реактивы
Исследуемые вещества
соляная кислота (конц.),
нитрит натрия (тв.)
анилин
В небольшом стакане (емкостью 50-100 мл) смешивают 3 г анилина, 25 мл воды и 7 мл концентрированной соляной кислоты. Полученный прозрачный раствор гидрохлорида анилина охлаждают до 0°С, поместив стакан с опущенным в него термометром в смесь воды со снегом или толченым льдом.
Отдельно готовят в пробирке раствор 2,3 г нитрита натрия в 4-5 мл воды и медленно по каплям прибавляют его к охлажденному раствору гидрохлорида анилина, перемешивая смесь палочкой и продолжая охлаждать. Температура смеси в течение всей работы не должна подниматься выше 5-7°С, для этого время от времени вносят в смесь маленькие кусочки льда (всего до 10-12 г). Несмотря на сильнокислую реакцию, из смеси не выделяются окислы азота – продукты распада свободной азотистой кислоты. Через 5-6 минут, когда введено около половины раствора нитрита натрия, добавление временно прекращают и перемешивают смесь еще в течение 1-2 мин. Затем наносят каплю смеси на иодкрахмальную бумажку, и если она не окрашивается в синий цвет (отрицательная проба на свободную азотистую кислоту), добавляют еще порцию нитрита натрия и повторяют пробу с иодкрахмальной бумажкой. Так делают до тех пор, пока проба на свободную азотистую кислоту не станет положительной. Этот момент обычно наступает, когда почти весь раствор нитрита натрия уже введен в реакцию.
Полученный почти прозрачный раствор хлорида фенилдиазония до проведения опытов с ним (см. разд. 5.2) оставляют во льду.
5.2. Образование азокрасителей реакциями азосочетания
Реакция азосочетания соли арилдиазония протеакет по механизму электрофильного ароматического замещения. Электрофилом служит соль диазония (диазокомпонент), а в качестве так называемого азокомпонента выступает активированный ароматический субстрат, содержащий в ядре электронодонорную группу (OH или NH2). Сочетание с фенолами обычно проводят в щелочной среде, а с аминами – в слабокислой.
Окраска азосоединений обусловлена наличием в молекуле хромофорной азо-группы –N=N-. В процессах окраски текстильных изделий для прочного соединения с волокном ткани необходимо наличие в молекуле азокрасителя групп кислого (-OH, -SO3H) или основного (NH2) характера – при крашении они дают возможность красителю образовать с амфотерными белками шерсти или шелка прочные солеобразные соединения. Растительные волокна, состоящие из целлюлозы (хлопок, лен), удерживают азокраситель обычно менее прочно. Заместители также влияют на оттенок окраски.
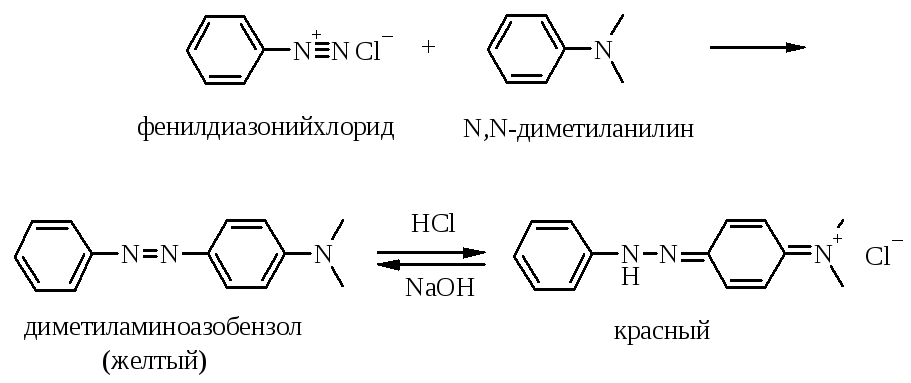
5.2.1. Азосочетание с аминами
Выполнение работы
-
Реактивы
Исследуемые вещества
соляная кислота (конц.),
раствор соли фенилдиазония,
диметиланилин
К 1-2 мл воды приливают 3-5 капель диметиланилина и переводят его в раствор, добавляя по каплям при встряхивании концентрированную соляную кислоту. Охлаждают полученный прозрачный раствор в холодной воде, и добавляют к нему 2-3 мл раствора фенилдиазонийхлорида, а затем 1-2 мл насыщенного раствора ацетата натрия и встряхивают смесь. Выделяются коричневато-желтые хлопья диметиламиноазобензола.
Несколько капель этой суспензии смешивают в пробирке с 5-7 мл воды. Образуется желтый раствор, который при подкислении краснеет (образуется соль, в которой заряд делокализован, причем катион имеет хиноидное строение), а при подщелачивании снова желтеет.
