
- •Образец оформления работы по качественному функциональному анализу
- •1. Реакции непредельных соединений
- •1.1. Тест на растворимость
- •1.2. Реакции ненасыщенных соединений с бромом
- •1.3. Окисление ненасыщенных соединений перманганатом калия
- •1.4. Образование и свойства этилена
- •1.6. Тест на присутствие в ненасыщенном соединении гидропероксидов
- •2. Реакции спиртов
- •2.1. Взамодействие спиртов с натрием
- •2.2. Реакции окисления спиртов
- •Окисление спиртов хромовой кислотой
- •Окисление этанола перманганатом калия
- •2.3. Реакции спиртов с неорганическими кислотами
- •2.3.1. Взаимодействие спиртов с серной кислотой
- •2.3.2. Взаимодействие одноатомных спиртов с борной кислотой
- •Обнаружение пероксидов в простых эфирах
- •3. Реакции вицинальных гликолей (1,2-диолов)
- •3.1. Реакция комплексообразования виц-диолов
- •3.1.1. Взаимодействие виц-диолов с борной кислотой
- •3.1.2. Взаимодействие виц-диолов с гидроксидом меди(II)
- •4. Реакции фенолов
- •4.1. Тест на растворимость фенолов
- •4.2. Комплексообразование фенолов с хлоридом железа(III)
- •4.3. Реакция фенолов с бромом
- •4.4. Реакции окисления фенолов
- •4.4.1. Окисление перманганатом калия
- •4.4.2. Окисление хромовой кислотой
- •5. Реакции диазотирования ароматических аминов
- •5.1. Диазотирование анилина
- •5.2. Образование азокрасителей реакциями азосочетания
- •5.2.1. Азосочетание с аминами
- •5.2.2. Азосочетание с фенолами
- •5.2.3. Окраска ткани азокрасителями
- •6. Реакции карбонильных соединений
- •6.1. Реакции альдегидов и кетонов по карбонильной группе
- •6.1.1. Реакция с 2,4-динитрофенилгидразином
- •6.1.2. Реакция с бисульфитом натрия
- •6.1.3. Реакция с сульфитом натрия
- •6.1.4. Реакция альдегидов с фуксинсернистой кислотой (реакция Шиффа)
- •6.2. Реакции окисления альдегидов
- •6.2.1. Окисление альдегидов хромовой смесью
- •6.2.2. Окисление альдегидов реактивом Фелинга
- •6.3. Реакции енольных форм
- •6.3.1. Образование дибензальацетона
- •6.3.2. Иодоформная проба
- •6.3.3. Реакция устойчивых енольных форм с хлоридом железа(III)
- •7. Реакции окси- и аминокислот
- •7.1. РеакциИ оксикислот с хлоридом железа(III)
- •7.1.1. Реакции алифатических оксикислот с хлоридом железа(III)
- •7.1.2. Реакции оксибензойных кислот с хлоридом железа(III)
- •7.2. РеакциИ коМплексообразования с участием
- •7.2.1. Реакции α-аминокислот с хлоридом железа(III)
- •7.2.2. Реакции α-аминокислот с солями меди(II)
- •7.3. Реакция аминокислот с нингидрином (реакция Руэманна)
- •7.4. Реакция аминокислот с формальдегидом
- •8. Реакции углеводов
- •8.1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •8.2. Реакция Селиванова на кетозы
- •8.3. Взаимодействие сахаров с солями двухвалентной меди в щелочном растворе
- •8.3.1. Доказательство наличия вицинальных гидроксильных групп
- •8.3.2. Окисление восстанавливающих сахаров соединениями двухвалентной меди (реакция Троммера)
- •8.4. Окисление моносахаридов йодом
1.4. Образование и свойства этилена
Выполнение работы
Этилен получают в пробирке со вставленной на пробке короткой газоотводной трубкой, к которой последовательно присоединяют с помощью резиновых трубок сначала короткую стеклянную трубку с мелкими кусочками натронной извести1, помещенной между двумя ватными тампонами, затем стеклянный наконечник.
Помещают в пробирку 1 мл спирта и осторожно, при взбалтывании, приливают 4 мл концентрированной серной кислоты. В разогревшуюся смесь бросают кипятильный камешек, присоединяют газоотводную трубку и начинают медленно и осторожно нагревать пробирку до начала равномерного выделения газа. Смесь при этом чернеет. Опускают газоотводную трубку в отдельные пробирки с бромной водой и раствором перманганата калия. В пробирках происходит обесцвечивание реагентов.
1.6. Тест на присутствие в ненасыщенном соединении гидропероксидов
Ненасыщенные соединения при хранении на воздухе под действием света способны окисляться с образованием гидропероксидов (окисление протекает по аллильному положению):
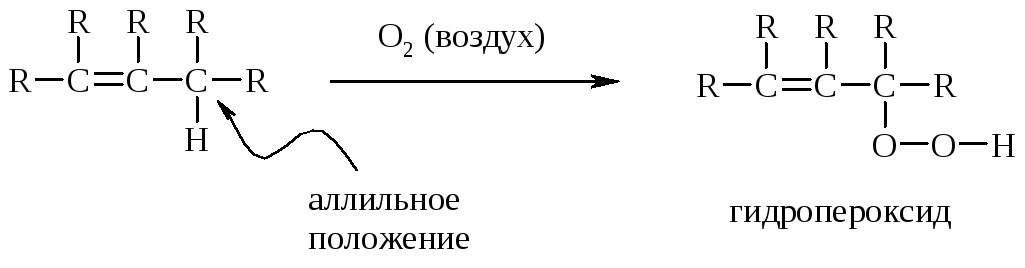
Гидропероксиды являются нестойкими соединениями, и могут разлагаться со взрывом (например, при нагревании). Поэтому прежде чем работать с алкеном, необходимо проверить, содержит ли его образец примесь гидропероксида, и если тест на его присутствие окажется положительным, то гидропероксид разлагают известным безопасным методом.
Определение в ненасыщенном соединении гидропероксидов основано на их способности окислять иодид-ион. Выделяющийся в результате реакции йод обнаруживают по образованию синего комплекса включения с крахмалом:
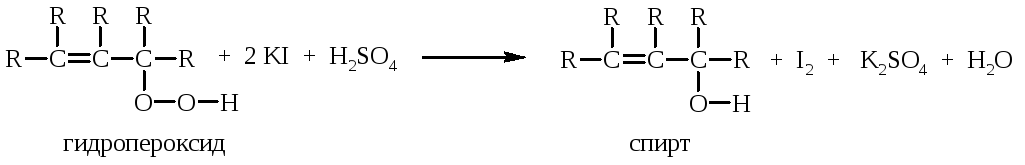
Выполнение работы
|
Реактивы |
Исследуемые вещества (2 в-ва): |
|
|
иодид калия (10% р-р), серная кислота (10%), крахмальный клейстер. |
а) децен-1, окись мезитила |
б) лимонен1 -пинен, циклогексен, олеиновая кислота. |
Примечание: 1При наличии в лаборатории
Параллельно с определением гидропероксида в алкене всегда следует проводить «холостой» опыт: к 1,5 мл 10%-го раствора иодида калия добавить 2-3 капли 10% серной кислоты и 0,5 мл свежеприготовленного крахмального клейстера. В воздушной атмосфере иодид-ион способен окисляться, при этом наблюдается небольшое посинение раствора.
Определение гидропероксидов: В две пробирки наливают по 1,5 мл 10%-го раствора иодида калия, добавляют по 2-3 капли 10% серной кислоты, по 0,5 мл свежеприготовленного крахмального клейстера и по 0,5 мл исследуемых ненасыщенных соединений [в одну пробирку децен-1 или окись мезитила, в другую – одно из ненасыщенных соединений из списка (б)]. Пробирки встряхивают и оставляют на некоторое время. Если в образце присутствует гидропероксид, то раствор постепенно окрашивается в синий цвет (более интенсивный, чем в «холостом» опыте).
2. Реакции спиртов
2.1. Взамодействие спиртов с натрием
Спирты реагируют с натрием, при этом выделяется водород и образуются алкоголяты натрия. Это взаимодействие демонстрирует кислотные свойства спиртов. Чем выше кислотность, тем более активно выделяется водород.
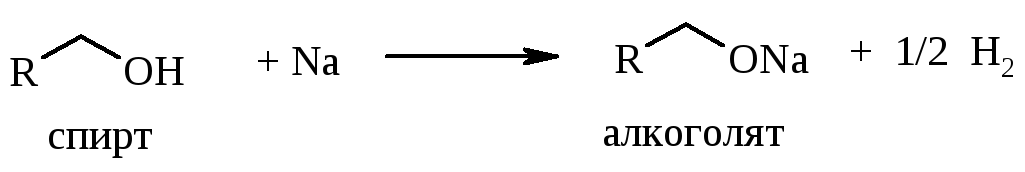
Реакция с активными металлами не является специфическим свойством спиртов. Карбоновые кислоты, фенолы, карбонильные соединения также вступают во взаимодействие с ними. Углеводороды – очень слабые кислоты и с натрием не взаимодействуют.
Выполнение работы
|
Реактивы |
Исследуемые вещества (3 в-ва): |
Вещества для холостого опыта (1 в-во) |
|
Натрий (мет.) |
а) вода, б) этанол, в) пропанол-2, бутанол-1. |
циклогексан, бензол, толуол. |
В две пробирки помещают по 2 мл исследуемых спиртов, в третью – 2 мл воды, в четвертую – вещество для холостого опыта, затем осторожно пинцетом в каждую пробирку прибавляют по небольшому кусочку натрия. В пробирках с исследуемыми веществами натрий растворяется. Отмечают интенсивность взаимодействия веществ с натрием и растворение металла и делают выводы об их относительной кислотности. В пробирке с холостым опытом видимых изменений не наблюдается.
Внимание! Содержимое пробирок не выливают до полного растворения натрия!
