
- •Образец оформления работы по качественному функциональному анализу
- •1. Реакции непредельных соединений
- •1.1. Тест на растворимость
- •1.2. Реакции ненасыщенных соединений с бромом
- •1.3. Окисление ненасыщенных соединений перманганатом калия
- •1.4. Образование и свойства этилена
- •1.6. Тест на присутствие в ненасыщенном соединении гидропероксидов
- •2. Реакции спиртов
- •2.1. Взамодействие спиртов с натрием
- •2.2. Реакции окисления спиртов
- •Окисление спиртов хромовой кислотой
- •Окисление этанола перманганатом калия
- •2.3. Реакции спиртов с неорганическими кислотами
- •2.3.1. Взаимодействие спиртов с серной кислотой
- •2.3.2. Взаимодействие одноатомных спиртов с борной кислотой
- •Обнаружение пероксидов в простых эфирах
- •3. Реакции вицинальных гликолей (1,2-диолов)
- •3.1. Реакция комплексообразования виц-диолов
- •3.1.1. Взаимодействие виц-диолов с борной кислотой
- •3.1.2. Взаимодействие виц-диолов с гидроксидом меди(II)
- •4. Реакции фенолов
- •4.1. Тест на растворимость фенолов
- •4.2. Комплексообразование фенолов с хлоридом железа(III)
- •4.3. Реакция фенолов с бромом
- •4.4. Реакции окисления фенолов
- •4.4.1. Окисление перманганатом калия
- •4.4.2. Окисление хромовой кислотой
- •5. Реакции диазотирования ароматических аминов
- •5.1. Диазотирование анилина
- •5.2. Образование азокрасителей реакциями азосочетания
- •5.2.1. Азосочетание с аминами
- •5.2.2. Азосочетание с фенолами
- •5.2.3. Окраска ткани азокрасителями
- •6. Реакции карбонильных соединений
- •6.1. Реакции альдегидов и кетонов по карбонильной группе
- •6.1.1. Реакция с 2,4-динитрофенилгидразином
- •6.1.2. Реакция с бисульфитом натрия
- •6.1.3. Реакция с сульфитом натрия
- •6.1.4. Реакция альдегидов с фуксинсернистой кислотой (реакция Шиффа)
- •6.2. Реакции окисления альдегидов
- •6.2.1. Окисление альдегидов хромовой смесью
- •6.2.2. Окисление альдегидов реактивом Фелинга
- •6.3. Реакции енольных форм
- •6.3.1. Образование дибензальацетона
- •6.3.2. Иодоформная проба
- •6.3.3. Реакция устойчивых енольных форм с хлоридом железа(III)
- •7. Реакции окси- и аминокислот
- •7.1. РеакциИ оксикислот с хлоридом железа(III)
- •7.1.1. Реакции алифатических оксикислот с хлоридом железа(III)
- •7.1.2. Реакции оксибензойных кислот с хлоридом железа(III)
- •7.2. РеакциИ коМплексообразования с участием
- •7.2.1. Реакции α-аминокислот с хлоридом железа(III)
- •7.2.2. Реакции α-аминокислот с солями меди(II)
- •7.3. Реакция аминокислот с нингидрином (реакция Руэманна)
- •7.4. Реакция аминокислот с формальдегидом
- •8. Реакции углеводов
- •8.1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •8.2. Реакция Селиванова на кетозы
- •8.3. Взаимодействие сахаров с солями двухвалентной меди в щелочном растворе
- •8.3.1. Доказательство наличия вицинальных гидроксильных групп
- •8.3.2. Окисление восстанавливающих сахаров соединениями двухвалентной меди (реакция Троммера)
- •8.4. Окисление моносахаридов йодом
4.3. Реакция фенолов с бромом
При взаимодействии фенолов с бромной водой происходит реакция электрофильного ароматического замещения. Замещение происходит во всех о,п-положениях (относительно OH-группы), если они не заняты заместителями. Например:
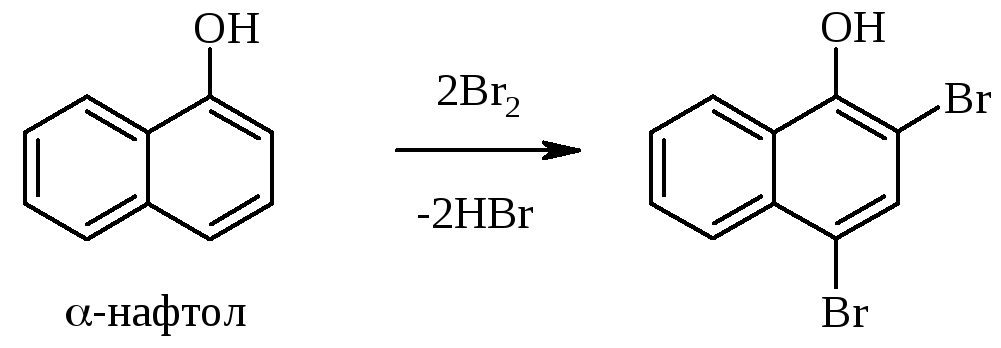
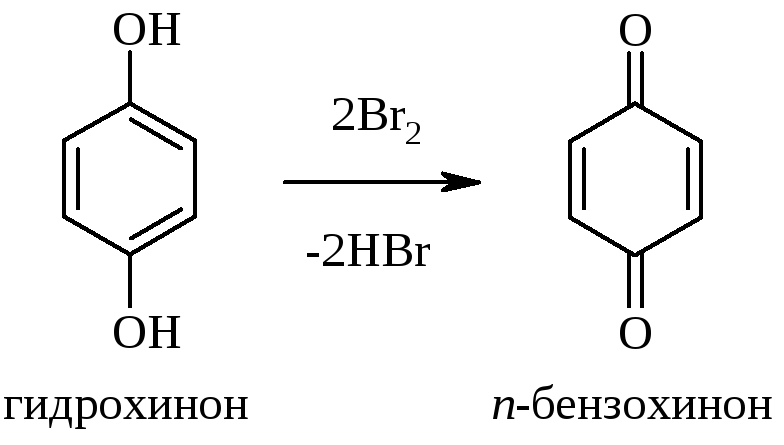
Бромирование фенолов протекает легко, т.к. OH‑группа – активирующий заместитель первого рода. Следует иметь в виду, что некоторые фенолы окисляются бромной водой, гидрохинон, например, превращается в п-бензохинон:
Легко вступают в реакцию с бромом анилины, т.к. группа NH2 – это также активирующий заместитель первого рода. Бромную воду обесцвечивают также алкены, алкины, и соединения, проявляющие восстановительные свойства.
Выполнение работы
|
Реактивы |
Исследуемые вещества (3 в-ва): |
Вещества для холостого опыта (1 в-во) |
|
бромная вода |
а) фенол, о-крезол, п-крезол, м-крезол, б) резорцин, пирокатехин, в) a‑нафтол, b‑нафтол. |
бензойная кислота. |
Осторожно! Бром вызывает сильные ожоги. Опыт следует проводить в вытяжном шкафу.
В трех пробирках готовят по 1 мл водных растворов исследуемых веществ (фенолов), в четвертой – раствор бензойной кислоты. В каждую из пробирок добавляют по каплям бромную воду при встряхивании. Положительным результатом теста (присутствие фенольного соединения) является исчезновение окраски брома. В некоторых случаях (фенол, нафтолы) бромированные фенолы выпадают в осадок.
В пробирке с бензойной кислотой окраска брома не изчезает.
4.4. Реакции окисления фенолов
Сильные окислители (перманганат калия, хромовая кислота) способны окислять фенолы. Реакция идет по пара-положению относительно ОН-группы, и образуются пара-хиноны, например:
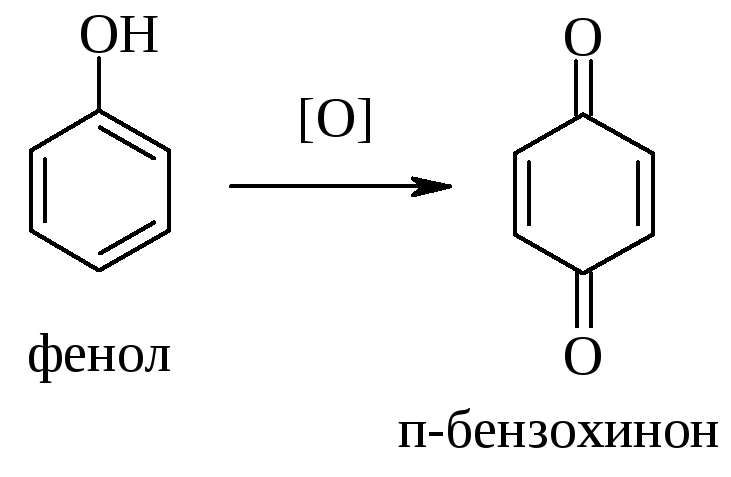
4.4.1. Окисление перманганатом калия
Выполнение работы
|
Реактивы |
Исследуемые вещества (1 в-во): |
Вещества для холостого опыта (1 в-во) |
|
карбонат натрия (5% р-р), перманганат калия (1% р-р). |
фенол, гидрохинон, ‑нафтол. |
бензойная кислота. |
В двух пробирках растворяют по нескольку кристаллов исследуемых веществ в 0.5-1 мл воды: в одной – фенол и в другой – бензойную кислоту. В каждую пробирку добавляют равный объем 5%-го раствора карбоната натрия и далее по каплям при перемешивании 1%-ный раствор перманганата калия. В пробирке с фенолом наблюдают исчезновение малиновой окраски реагента и выпадение бурого осадка оксида марганца. В пробирке с бензойной кислотой малиновая окраска реагента не исчезает (холостой опыт)
4.4.2. Окисление хромовой кислотой
Выполнение работы
|
Реактивы |
Исследуемые вещества (1 в-во): |
Вещества для холостого опыта (1 в-во) |
|
бихромат калия (5% р-р), серная кислота (конц.) |
фенол, гидрохинон, ‑нафтол. |
бензойная кислота. |
В двух пробирках готовят хромовую смесь: к 2-5 каплям 5% раствора бихромата калия осторожно добавляют 2 капли концентрированной серной кислоты. Добавляют в одну пробирку 5 капель исследуемого фенола, а в другую – бензойную кислоту, встряхивая после добавления каждой капли. В пробирке с фенолом наблюдается переход оранжевой окраски в коричнево-зеленую (положительная проба). В случае отрицательного теста (в холостом опыте) раствор останется оранжевым.
