
- •Образец оформления работы по качественному функциональному анализу
- •1. Реакции непредельных соединений
- •1.1. Тест на растворимость
- •1.2. Реакции ненасыщенных соединений с бромом
- •1.3. Окисление ненасыщенных соединений перманганатом калия
- •1.4. Образование и свойства этилена
- •1.6. Тест на присутствие в ненасыщенном соединении гидропероксидов
- •2. Реакции спиртов
- •2.1. Взамодействие спиртов с натрием
- •2.2. Реакции окисления спиртов
- •Окисление спиртов хромовой кислотой
- •Окисление этанола перманганатом калия
- •2.3. Реакции спиртов с неорганическими кислотами
- •2.3.1. Взаимодействие спиртов с серной кислотой
- •2.3.2. Взаимодействие одноатомных спиртов с борной кислотой
- •Обнаружение пероксидов в простых эфирах
- •3. Реакции вицинальных гликолей (1,2-диолов)
- •3.1. Реакция комплексообразования виц-диолов
- •3.1.1. Взаимодействие виц-диолов с борной кислотой
- •3.1.2. Взаимодействие виц-диолов с гидроксидом меди(II)
- •4. Реакции фенолов
- •4.1. Тест на растворимость фенолов
- •4.2. Комплексообразование фенолов с хлоридом железа(III)
- •4.3. Реакция фенолов с бромом
- •4.4. Реакции окисления фенолов
- •4.4.1. Окисление перманганатом калия
- •4.4.2. Окисление хромовой кислотой
- •5. Реакции диазотирования ароматических аминов
- •5.1. Диазотирование анилина
- •5.2. Образование азокрасителей реакциями азосочетания
- •5.2.1. Азосочетание с аминами
- •5.2.2. Азосочетание с фенолами
- •5.2.3. Окраска ткани азокрасителями
- •6. Реакции карбонильных соединений
- •6.1. Реакции альдегидов и кетонов по карбонильной группе
- •6.1.1. Реакция с 2,4-динитрофенилгидразином
- •6.1.2. Реакция с бисульфитом натрия
- •6.1.3. Реакция с сульфитом натрия
- •6.1.4. Реакция альдегидов с фуксинсернистой кислотой (реакция Шиффа)
- •6.2. Реакции окисления альдегидов
- •6.2.1. Окисление альдегидов хромовой смесью
- •6.2.2. Окисление альдегидов реактивом Фелинга
- •6.3. Реакции енольных форм
- •6.3.1. Образование дибензальацетона
- •6.3.2. Иодоформная проба
- •6.3.3. Реакция устойчивых енольных форм с хлоридом железа(III)
- •7. Реакции окси- и аминокислот
- •7.1. РеакциИ оксикислот с хлоридом железа(III)
- •7.1.1. Реакции алифатических оксикислот с хлоридом железа(III)
- •7.1.2. Реакции оксибензойных кислот с хлоридом железа(III)
- •7.2. РеакциИ коМплексообразования с участием
- •7.2.1. Реакции α-аминокислот с хлоридом железа(III)
- •7.2.2. Реакции α-аминокислот с солями меди(II)
- •7.3. Реакция аминокислот с нингидрином (реакция Руэманна)
- •7.4. Реакция аминокислот с формальдегидом
- •8. Реакции углеводов
- •8.1. Общая реакция на углеводы с -нафтолом (реакция Молиша)
- •8.2. Реакция Селиванова на кетозы
- •8.3. Взаимодействие сахаров с солями двухвалентной меди в щелочном растворе
- •8.3.1. Доказательство наличия вицинальных гидроксильных групп
- •8.3.2. Окисление восстанавливающих сахаров соединениями двухвалентной меди (реакция Троммера)
- •8.4. Окисление моносахаридов йодом
3.1.2. Взаимодействие виц-диолов с гидроксидом меди(II)
1,2-Диолы способны давать хелатные комплексы с гидроксидом меди(II). В полученном комплексе атом меди четырехкоординирован, образуя две ковалентные связи и две донорно-акцепторные связи (указаны пунктирными линиями) с атомами кислорода ОН-групп диола. В условиях опыта (щелочная среда) происходит отщепление протонов и образуется комплексный анион (окрашен):
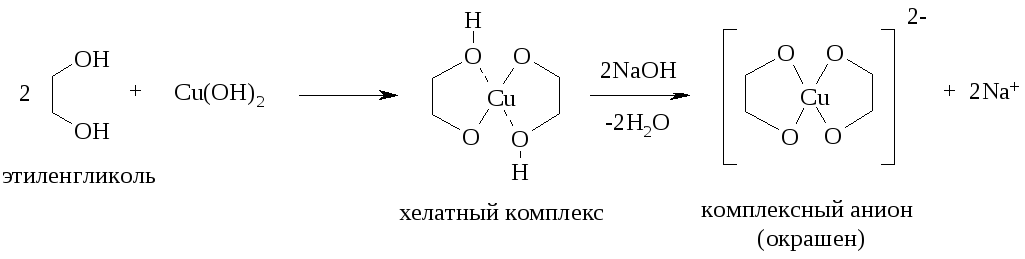
Отметим, что образование таких комплексов для одноатомных спиртов невозможно. Подобные реакции, сопровождающиеся хелатированием, протекают также с -аминоспиртами и -аминокислотами.
Выполнение работы
|
Реактивы |
Исследуемые вещества (1 в-во): |
Вещества для холостого опыта (1 в-во) |
|
сульфат меди (3% р-р), гидроксид натрия (5% р-р)
|
1,2-этандиол (этиленгликоль), 1,2,3-пропантриол (глицерин), 1,2,3,4,5,6-гексангексаол (маннит) |
этанол, пропанол-2. |
В две пробирки наливают по 10 капель 3% раствора сульфата меди и по 1 мл 5% раствора гидроксида натрия. К полученной смеси быстро добавляют: в одну пробирку три капли исследуемого диола, в другую – одноатомный спирт. В пробирке, где присутствует 1,2-диол, голубой осадок свежевыпавшего гидроксида меди растворяется и раствор приобретает интенсивную синюю окраску. В другой пробирке видимых изменений не наблюдается (холостой опыт).
4. Реакции фенолов
4.1. Тест на растворимость фенолов
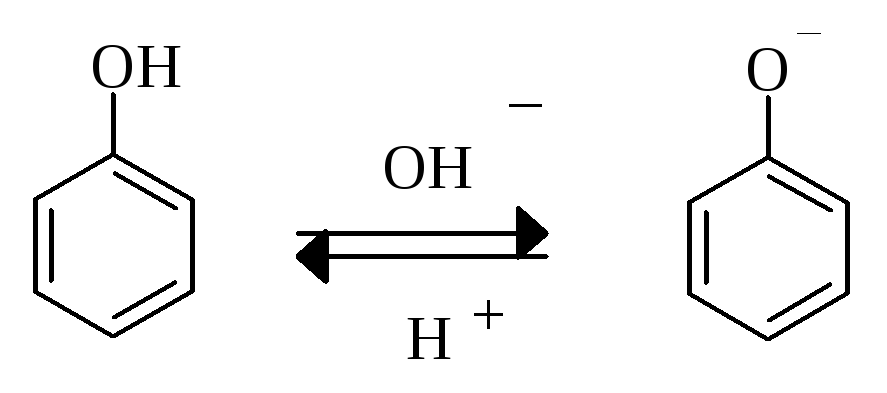
Фенолы при комнатной температуре умеренно растворимы в воде. Их растворимость значительно увеличивается при повышении температуры и при увеличении pH раствора (за счет выраженных кислотных свойств фенолов). Сильные кислоты вытесняют фенолы из их солей, так как кислотность фенолов все же не так велика.
Выполнение работы
|
Реактивы |
Исследуемые вещества (1 в-во): |
Вещества для холостого опыта (1 в-во) |
|
гидроксид натрия (разб. р-р), карбонат натрия (насыщ. р-р), гидрокарбонат натрия (насыщ. р-р) серная кислота (разб.) |
фенол, гидрохинон, резорцин, пирокатехин, a-нафтол, b-нафтол. |
бутанол-1, бутанол-2, 3-метилбутанол-1 (изоамиловый спирт). |
В четыре пробирки помещают по 0.3-0.5 г исследуемого фенола и добавляют по 1 мл: в одну пробирку воды, в другую – раствора щелочи, в третью – раствора карбоната, в четвертую – раствор гидрокарбоната натрия. Отмечают, в каких пробирках произошло растворение фенола, после чего содержимое этих пробирок подкисляют раствором серной кислоты.
Параллельно в две пробирки помещают по 0,5 г одноатомного спирта, добавляют по 1 мл: в одну пробирку воды, в другую – раствора щелочи (холостой опыт). Отмечают наблюдаемые изменения.
4.2. Комплексообразование фенолов с хлоридом железа(III)
Фенолы взаимодействуют с раствором хлорида железа(III) с образовением комплексов сложного состава. Упрощенное уравнение для фенола можно представить так:
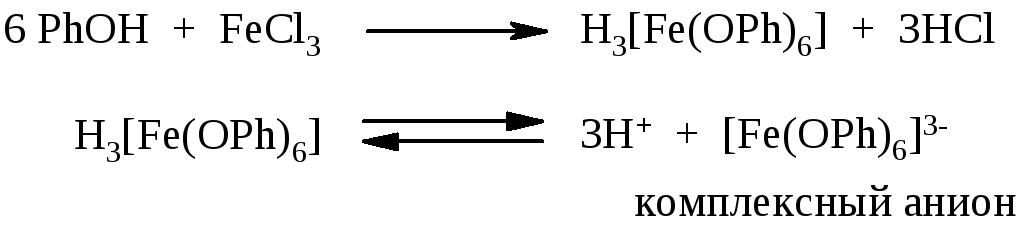
Окраска комплекса зависит от природы фенола, вступающего в реакцию. Так, фиолетовая окраска характерна для фенола, резорцина, a-нафтола, синяя – для крезолов, зеленая – для пирокатехина, b-нафтола.
Гидрохинон под действием хлорида железа(III) окисляется до п-бензохинона, который может дать черный комплекс (хингидрон) с не вступившим в реакцию (избытком) гидрохиноном, поэтому при проведении опыта синяя окраска комплекса с железом исчезает, но могут появиться черные блестящие кристаллы:
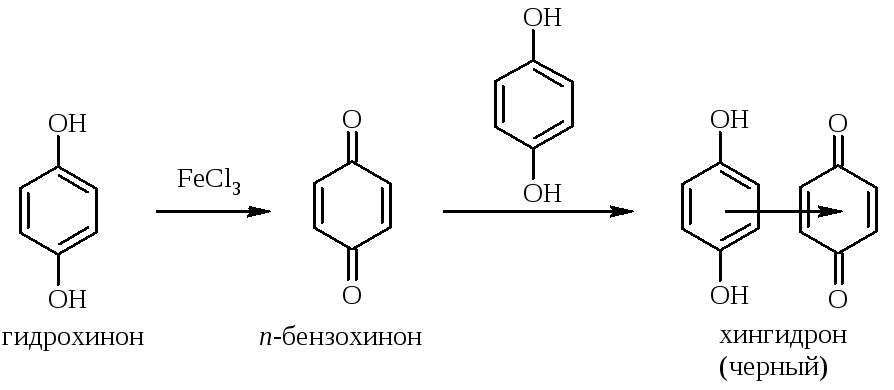
Окрашенные комплексы с солями железа образуют также аминокислоты и карбонильные соединения, образующие устойчивые енольные формы (например, ацетоуксусный эфир).
Выполнение работы
|
Реактивы |
Исследуемые вещества (3 в-ва): |
Вещества для холостого опыта (1 в-во) |
|
хлорид железа(III) (3% р-р) |
а) фенол, о-крезол, п-крезол, м-крезол, б) гидрохинон, в) резорцин, пирокатехин, a-нафтол, b-нафтол, |
этанол, пропанол-2. |
В трех пробирках готовят разбавленные водные растворы исследуемых фенолов, в четвертой – вещество для холостого опыта. Для этого к небольшому количеству вещества (несколько капель или кристаллов) добавляют 1 мл воды и пробирку встряхивают. Если растворение происходит медленно, то содержимое пробирки нагревают на водяной бане, а перед проведением теста пробирку охлаждают.
К полученным растворам добавляют по 1-2 капли 3% раствора FeCl3, в пробирках с фенольными соединениями наблюдается интенсивное окрашивание раствора (положительный результат теста).
