
- •2.Значение биохимии для диагностики заболеваний.
- •3. Значение биохимии для лечения. Выявление нарушенных звеньев метаболизма и создание соответствующих лекарственных препаратов, широкое использование природных препаратов.
- •4.Значение биохимии для профилактики заболеваний.
- •1 .Альфа спираль ( л.Поллинг) - виток составляет от 3 до 6 ак. Терминатором спирали является ак-пролин.
- •2.Бетта складчатый слой.
- •3.Петли полипептидной цепи (соединительные петли).
- •2.Способность белков связываться с лигандами,
- •3.Электрохимические свойства белков.
- •1. Концевыми соон и nh2 группами.
- •2.Боковыми группами:
- •1.Ионообменная хроматография.
- •2.Разделение белков на основании величины заряда - электрофорез белков. С помощью электрофореза в сыворотке крови выделяют как минимум 5 фракций: альбумины, альфа, альфа-2, гамма, бета - глобулины.
- •4.Коллоидные свойства белков.
- •5. Гидратация белков - способность белков связывать воду. Она осуществляется за счёт:
- •1 .Белковой частью (состоит из ак) - апофермент;
- •2.Небелковой частью - кофактор.
- •4.Специфичность действия ферментов. В основе специфичности действия ферментов лежит конформационное соответствие его активного центра молекуле субстрата. Различают следующие виды специфичности:
- •1.Обратимые - это соединения, которые нековалентно взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации.
- •1 .Механизм окислительного фосфорилирования.
- •2.Альтернативные пути биологического окисления.
- •3.Свободно-радикальное окисление.
- •1.Мембрана митохондрий не проницаема для протонов.
- •2.Образуется протонный потенциал в процессе транспорта электронов и протонов.
- •3.Обратный транспорт протонов в матрикс сопряжен с образованием атф.
- •2. Вторичные радикалы (он, липидные радикалы – l,, lo,, loo,) Их образование происходит с участием железа (11). Это патологические продукты.
- •3. Третичные радикалы (антиоксиданты) - образуются под влиянием вторичных радикалов.
- •2.Она раздражает слизистую оболочку жкт, усиливая секрецию желёз.
- •3.Усиливает сокращение кишечника,
- •4.В толстом кишечнике под действием ферментов условно-патогенной микрофлоры клетчатка подвергается брожению с образованием глюкозы, лактозы и газообразных веществ.
- •1. Основной фосфоролитический путь
- •2.Неосновной амилолитический.
- •1.Надф*н2, который в отличии от надн2 не используется вдыхательной цепи митохондрий, а поступает клетке для реакций синтеза и восстановления веществ.
- •2.Рибозо-5-фосфата и др. Пентоз, которые используются в клетке для синтеза важнейших биологических молекул: днк, рнк, нтф (атф, гтф, цтф, ттф),н5коа, над, фад).
- •1. Транскетолазные реакции:
- •2. Трансальдолазная реакция:
- •1. Ув пищи,
- •2. Гликоген тканей
- •3. Глюконеогенез.
- •1.Липиды, их классификация и биологическая роль.
- •2.Превращение липидов в органах пищеварения.
- •1.Структурными липидами.
- •2.Резервными липидами.
- •3.Свободными липидами. — хиломикроны,
- •1. Эмульгируют пищевые жиры.
- •2. Активируют липолитические ферменты.
- •3. Выполняют роль переносчиков трудно растворимых в воде продуктов гидролиза жира и жирорастворимых витаминов a, d, е, к.
- •1.Транспортные липопротеины крови. Состав и биологическая роль. 2.Простагландины, простациклины, тромбоксаны, лейкотриены. Механизм их образования и биологическая роль.
- •3.Окисление глицерина и вжк в тканях.
- •1.Простагландины:
- •1.Биосинтез вжк в тканях, химизм реакций, биологическая роль. 2.Холестерин, биологическая роль, биосинтез, окисление. 3.Патология липидного обмена.
- •1.Наличие атф, со2, н2о, надф*н2, поступающий из гексозомонофосфатного пути превращения глюкозы.
- •2.Наличие специальных белков-переносчиков (hs -апб). 3.Наличие специальных ферментов синтеза.
- •1.Структурная. Свободный холестерин является, обязательным структурным компонентом мембран клеток.
- •2.Метаболическая. Холестерин является предшественником биологически активных веществ: витамина d3
- •1. Пища. За сутки в организм взрослого человека поступает 0,3гр. Холестерина.
- •1 .На этапе поступления жиров с пищей:
- •2.На этапе пищеварения.
- •2.На этапе пищеварения.
- •2.Бета -аминоизобутират.
- •1. Нарушение на этапе поступления белков. В норме в организм должно поступать 80 - юОгр белков. Обязательно поступление всех незаменимых ак.
- •2. Нарушение на этапе пищеварения:
- •3. Нарушение межуточного обмена - нарушение обмена аминокислот в тканях.
- •5. Праймеры - «затравка» для репликации. Это короткий фрагмент, состоящий из рибонуклеотидтрифосфатов (2 - 10). Образование праимеров катализируется праймазой.
- •1.Инициация репликации.
- •2. Репарация днк.
- •3. Транскрипция гена.
- •1.Рекогниция (распознавание) - узнавание между аминокислотами и их транспортной
- •3. Инициация - начало процесса трансляции.
- •4. Элонгация (продолжение) протекает циклически в виде последовательной смены трёх фаз:
- •5. Терминация (прекращение).
- •6. Броцессинг белка (созревание) совокупность химических модификаций
- •1. Регуляция происходит только на уровне транскрипции. Первичные транскрипты генов у них транслируются до завершения транскрипции.
- •1. Первые представления о гене.
- •2. Современные представления о природе биохимического полиморфизма.
- •3. Современные представления структурно-функциональной организации днк.
- •1. Выделение днк из биологического материала.
- •2. Амплификация - репликация на органическом участке молекулы днк. Производится за счёт работы ферментов и смены температурных режимов.
- •3. Детекция продуктов pcr (копий заданного участка) Схема pcr:
- •1. Структурные гены
- •2. Регуляторные элементы
- •1. Фенотипическое различие между клетками,
- •2. Индивидуальные различия между организмами одного вида. Каждый человек отличается от другого человека на 0,1% генома.
- •3. Широкое разнообразие белков. На основе 35000 генов синтезируются около 5000000 белков. В настоящее время нельзя сказать точно, что изучать важнее - геном или белковый состав организма.
- •1. Углеводный обмен:
- •Высококалорийное питание,
- •Преобладание консервированных продуктов в рационе, рафинированных или высокоочищенных продуктов,
- •Малое движение (гиподинамия).
- •Регулирует интенсивность свободно радикальных процессов. Препятствует активации перекисного окисления жиров, обеспечивая тем самым стабильность биологических мембран.
- •Витамин е повышает биологическую активность витамина а.
- •1. Участие в окислительно-восстановительных реакциях:
- •2. Синтез кортикостероидов
- •Высокая потребность,
- •Неустойчивость химической структуры,
- •Отсутствие депо.
- •1. Входит в состав тдф: тиамин(атф) ® тдф
- •2.Участвует в передаче нервного импульса.
- •I. Метилирование в12
- •2.Деметелирование в12 метилтетрогидрофолевая к-та ® тетрогидрофолевая к-та
- •II. Аденозилкобаламин в12
- •1. Является ко-ферментом карбоксилаз пвк, ацетил -коа, пропионил-коа.
- •2. Участвует в реакциях синтеза жирных кислот и стерина.
- •1. Входит в состав ко-фермента а, следовательно, участвует в синтезе ацетил-коа, различных ацил-коа, образующихся в результате следующих реакций:
- •2. Участвует в синтезе более 80 различных ферментов.
- •Витаминоподобные вещества.
- •1. Прямо воздействующие:
- •2. Структуры аналогичные витаминам:
- •1. Надпеченочная желтуха (гемолитическая).
- •2. Печеночная желтуха (токсические и вирусные и другие гепатиты).
- •3. Подпеченочная желтуха (механическая).
- •1. Транспортирует ионы меди, связывает и удерживает их в кровеносном русле
- •3. Обладает противовоспалительным действием
- •4. Является антиоксидантом, обезвреживает активные формы кислорода и пол.
- •IgD. Функция неизвестна.
- •1. Метаболиты: аминокислоты (25%), креатин (5%), полипептиды и нуклеотиды (3,5%)
- •2. Конечные азотистые продукты: мочевина(50%), мочевая кислота (4%), креатинин (2,5%), индикан и аммиак.
- •1.Экскреторная функция - это выделение мочевины, мочевой кислоты, креатина, лекарств, токсинов, избытка воды, микроэлементов, электролитов. Состоит из трёх фаз:
- •2.Регуляторная и гомеостатическая.
0Лекция № 1.
Биохимия, её задачи. Структурная организация белков.
1 .Предмет биохимии.
2.Задачи биохимии.
3.Значение биохимии для медицины.
4.Белки,их биологическая роль.
5.Структурная организация белков.
Биохимия относится к фундаментальным дисциплинам медицины и биологии. В результате научного познания мира выделился ряд фундаментальных дисциплин: философия, физика, химия, биология и д.р. Биохимия выделилась с одной стороны в результате разделения наук. Ей не доставало точности, т.к. длительно она была описательной наукой. Середина 20 в. ознаменовалась глобальными открытиями в физике. В это же время интеграция биологии с точными науками способствовала её бурному развитию. Биохимия возникла как наука, благодаря привлечению в биологию точных знаний, в частности химии.
Биохимия—наука о структуре веществ, входящих в состав живого организма, их превращениях и физико-химических процессах, лежащих в основе жизнедеятельности.
Выделяют три составных компонента общей биохимии:
1.Статическая биохимия (изучает структуру веществ ) - биоорганическая химия.
2.Динамическая биохимия (изучает превращение веществ в организме).
3.Функциональная биохимия ( изучает процессы, лежащие в основе функций органов и тканей). Кроме общей (базисной) биохимии выделяют ещё ряд разделов биохимии, в зависимости от направления проводящихся исследований:
1.Биохимия растений.
2.Биохимия микроорганизмов.
3.Биохимия животных.
4.Медицинская биохимия.
5.Ветеринарская биохимия.
6.Техническая биохимия.
7.Биохимия генетики.
8.Молекулярная биохимия.
Задачи биохимии.
1.Изучение процессов БИОКАТАЛИЗА.
2.Изучение механизмов наследственности на молекулярном уровне.
3.Изучение строения и обмена нуклеиновых кислот.
4.Изучение строения и обмена белков.
5.Изучение превращения углеводов.
6.Изучение обмена жиров.
7.Изучение биологической роли сигнальных молекул (ГОРМОНЫ, НЕЙРОМЕДИАТОРЫ).
8.Изучение роли витаминов в обмене веществ.
9.Изучение роли минеральных веществ.
Значение биохимии для медицины.
Основные вопросы медицины: патогенез, диагностика, лечение и профилактика заболеваний.
1.Значение биохимии для понимания механизма заболевания.
ПРИМЕР. В норме, ГЕМОГЛОБИН-А располагается в эритроцитах равномерно, занимая весь объём клетки. При смене 1 АК ГЛУТАМИНА на ВАЛИН образуется ГЕМОГЛОБИН-S, плохо растворимый и выпадающий в эритроцитах в осадок. Сущность этого заболевания раскрыл Л. ПОЛЛИНГ. Только биохимические исследования позволяют диагностировать это заболевание и раскрыть механизм развития вследствие недостатка гормона инсулина. Сердечно-сосудистые заболевания (атеросклероз). Раньше считали, что важную роль в патогенезе принадлежит накоплению ЛИПОПРОТЕИНОВ низкой плотности и нарушение соотношения между ЛИПОПРОТЕИНАМИ низкой плотности и ЛИПОПРОТЕИНАМИ высокой плотности. В настоящее время предполагают, что важным является чувствительность рецепторов клеток к ЛИПОПРОТЕИНАМ низкой плотности.
2.Значение биохимии для диагностики заболеваний.
Широкое использование биохимических исследований биологических жидкостей.
A. Количество субстратов.
Б. Исследование активности ферментов.
B. Исследование уровня гормонов. Методы РИА, ИФА, ИХЛА, ДНК-зонды.
Важным моментом в настоящее время является выявление ПРЕДЗАБОЛЕВАНИЙ.
3. Значение биохимии для лечения. Выявление нарушенных звеньев метаболизма и создание соответствующих лекарственных препаратов, широкое использование природных препаратов.
4.Значение биохимии для профилактики заболеваний.
ПРИМЕР. Недостаток витамина С —цинга—для профилактики использование витамина С (профилактика простудных заболеваний).
Недостаток витамина D— рахит— использование витамина D.
БЕЛКИ, ИХ БИОЛОГИЧЕСКАЯ РОЛЬ.
Белки - это высокомолекулярные азотсодержащие органические вещества, состоящие из АК. соединённых ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь, и имеющие сложную структурную организацию.
Характерные признаки белков, отличающие их от других соединений:
1 .Белки - АЗОТСОДЕРЖАЩИЕ вещества (до 16 %).
2.Структурной единицей белков являются альфа АК L-РЯДА.
![]()
3-.АК связываются ПЕПТИДНЫМИ связями в ПОЛИПЕПТИДНУЮ цепь.
4.Большая молекулярная масса белков (от 20000 до нескольких миллионов дальтон).
5.Сложная структурная организация.
ФУНКЦИИ БЕЛКОВ.
1.Каталитическая. Многие белки являются ферментами
2.Регуляторная. Некоторые гормоны являются белками
3.Структурная. Во все структуры живой клетки входят белки.
4.Рецепторная. Белки являются обязательным компонентом рецепторов, способны узнавать другие молекулы.
5.Транпортная. Транспорт жиров, лекарственных веществ и д.р.
6.Опорная. Коллаген, белки костной ткани.
7.Энергетическая. Окисление 1 грамма белка сопровождается выделением 17 КДЖ энергии. В сутки 15% энергии образуется за счёт распада Б.
8.Сократительная. Актин, миозин мышц.
9.Генно-регуляторная (ГИСТОНЫ).
10.Иммунологическая. Антитела являются белками.
11 .Гемостатическая. Фибриноген.
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ. Свойства белков обусловлены их структурой.
ПЕРВИЧНАЯ СТРУКТУРА - последовательное соединение АК в ПОЛИПЕПТИДНОЙ цепи с помощью ПЕПТИДНЫХ связей.
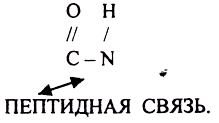
Свойства ПОЛИПЕПТИДНОЙ цепи зависят от составляющих её АК.
Порядок АК в цепи устанавливается с помощью СЕКВЕНИРОВАНИЯ - процедура выявления последовательности АК. Впервые было проведено в 1958 г. Ф. СЕНДЖЕРОМ на инсулине.
ВТОРИЧНАЯ СТРУКТУРА - способ укладки в пространстве ПОЛИПЕПТИДНОЙ цепи. Образуется за счет водородных связей между 1 и 4 АК.
![]()
Выделяют 3 вида вторичной структуры:
1 .Альфа спираль ( л.Поллинг) - виток составляет от 3 до 6 ак. Терминатором спирали является ак-пролин.
2.Бетта складчатый слой.
3.Петли полипептидной цепи (соединительные петли).
ТРЕТИЧНАЯ СТРУКТУРА - укладка вторичной структуры более компактно, в виде ГЛОБУЛЫ или ФИБРИЛЛЫ. Осуществляется за счёт водородных, ионных, ДИСУЛЬФИДНЫХ и гидрофобных связей.
Домены - это фрагменты ПОЛИПЕПТИДНОЙ цепи, сходные по свойствам с самостоятельными глобулярными белками. Домен автономен. Домены возникают в результате слияния нескольких генов отдельных белков.
ЧЕТВЕРТИЧНАЯ СТРУКТУРА - объединение нескольких доменов. П. Гемоглобин-4 СУБЪЕДИНИЦЫ.
ЛЕКЦИЯ № 2.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. КЛАССИФИКАЦИЯ БЕЛКОВ.
1.Физико-химические свойства белков. Их использование для разделения белков.
2.Принципы классификации белков.
3.Характеристика простых белков.
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ.
1.Молекулярная масса белков определяет многие свойства белков: седиментация, диффузия, плотность белковых растворов, коллоидные свойства белков и др. характеристики.
Молекулярная масса: инсулин (5700)
МИОГЛОБИН (17000)
ПЕПСИН (35000)
ГЕМОГЛОБИН (65000).
Молекулярную массу белка можно определить по скорости седиментации (осаждения) при УЛЬТРАЦЕНТРИФУГИРОВАНИИ, т.е. при ускорении 100000-500000 дальтон. На основании этого определяют коэффициент седиментации, который обозначают S ( в честь СВЕДБЕРГА). Он предложил за единицу коэффициента седиментации величину 10-13 степени. S большинства белков колеблется в пределах 1-2 СВЕДБЕРГОВ. Др. методом определения молекулярной массы является метод ГЕЛЬФИЛЬТРАЦИИ (молекулярное просеивание). Используется искусственно созданные гранулы, имеющие поры (гранулы СЕФАДЕКСА). Внутрь гранулы могут проникать только соединения определённого размера: молекулы небольшого размера входят в гранулы, а большие быстрее вымываются. Молекулярная масса рассчитывается ориентировочно. Буфер не задерживается, а белок движется тем медленнее, чем меньше молекулярная масса.
