
- •Неметаллы
- •6. Физические свойства и строение неметаллов
- •7. Получение неметаллов
- •8. Химические свойства неметаллов.
- •9. Соединения неметаллов с водородом
- •10. Соединения неметаллов с кислородом
- •Строение и физические свойства оксидов
- •Получение и химические свойства оксидов
- •11. Кислородные кислоты и их соли
- •Соли кислородных кислот
- •Галогены. Общая характеристика
- •2. Галогены в природе. Получение галогенов.
- •Взаимодействие галогенов с водой.
- •11.1. Оксокислоты hxo и их соли.
- •11.2. Оксокислоты hxo2
- •11.3. Свойства кислот hxo3 и их солей.
- •11.4. Оксокислоты hxo4.
- •Материалы на основе галогенов и их соединений.
- •Фтор и его соединения
- •Физические свойства
- •Хлор и его соединения
- •Соединения хлора Хлористый водород
- •Химические свойства
- •Кислородсодержащие кислоты хлора
- •Бром и его соединения
- •Химические свойства
- •Бромистый водород hBr
- •Иод и его соединения
- •Химические свойства
- •Иодистый водород
- •Кислородные кислоты йода
10. Соединения неметаллов с кислородом
Кислород является вторым по электроотрицательности элементом, и в соединениях с его участием все неметаллы, кроме фтора, проявляют положительные степени окисления.
Максимальная степень окисления неметалла равна числу электронов на валентных подуровнях, то есть номеру группы Периодической системы. Групповую степень окисления не проявляют только F, At и инертные газы от He до Kr.
К кислородным соединениям относят оксиды, отвечающие им кислоты (гидроксиды) и соли этих кислот.
ПРИМЕР.
N2O5 – оксид азота (+5) или азотный ангидрид – групповая степень окисления,
HNO3 – азотная кислота или гидроксид азота (+5) NO2(OH),
KNO3 – нитрат калия (соль азотной кислоты).
Помимо высшей степени окисления n (n – номер группы, верхние строчки в каждой клеточке таблицы), у большинства неметаллов достаточно устойчива в кислородных соединениях степень окисления n–2: (нижние строчки):
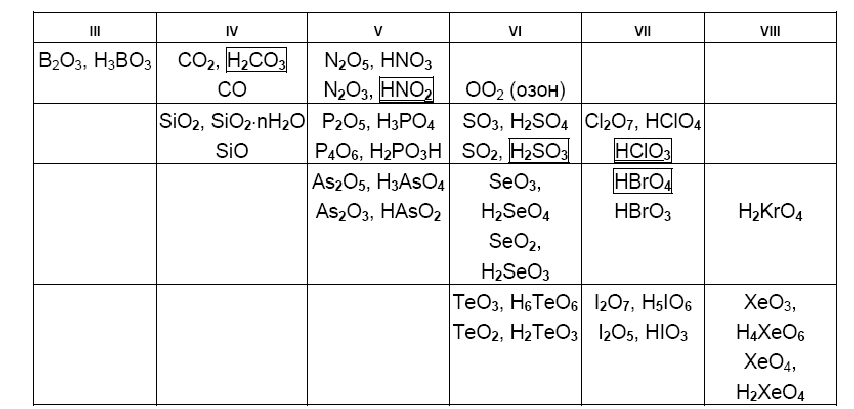
Обведены кислоты, устойчивые только в водных растворах.
Химическая связь в оксидах, кислородных кислотах и анионах солей – полярная ковалентная. Общая электронная пара смещена при этом к кислороду:
H : H H :O
неполярная полярная.
В некоторых молекулярных оксидах есть связь неметалл–неметалл:N2O4, N2O.
Ряд молекул оксидов содержит неспаренные электроны:NO, NO2, ClO2, ClO3.
Это оксиды элементов нечётных групп в чётной степени окисления. Атомы или молекулы с неспаренными электронами в химии называют радикалами. Они интенсивно взаимодействуют с электромагнитными полями: втягиваются в магнитное поле (парамагнитны) и обычно имеют интенсивную окраску из-за поглощения света. Их химическая активность высока.
Связь между анионом и катионом соли – ионная, например, между K+ и NO3–.
Ионная связь имеется также в N2O5: между NO2+ и NO3–.
Строение и физические свойства оксидов
Большинство неметаллов образует по несколько оксидов, отвечающих разным степеням окисления, например, S+4O2 и S+6O3, C+2O и C+4O2.
По физическим свойствам это могут быть:
-
- газы – NO, CO, ClO2,
-
- жидкости – Cl2O7, N2O3 около 0 °С,
-
- твёрдые вещества, среди которых отличают:
растворимые или летучие, химически активные – SO3, N2O5, P2O5,
тугоплавкие и инертные – B2O3, TeO2 и, особенно, SiO2.
Атом неметалла в оксидах образует с кислородом от одной до шести связей. Напоминаю, это число ближайших соседей называют координационным числом (КЧ). Формула оксида не всегда указывает на КЧ.
ПРИМЕР.
В CO2 КЧ(С) =2, в кварце SiO2 КЧ(Si) = 4.
В оксидах металлов: в рутиле TiO2 КЧ(Ti)=6, в ThO2 КЧ(Th)=8. Как видно, КЧ определяется преимущественно размером центрального атома, точнее, катиона, так как связь с кислородом достаточно полярна.
Если отношение числа атомов Э/О в формуле оксида меньше, чем КЧ, это указывает на сложное, обычно немолекулярное строение оксида. Полимеризация усиливается в периоде справа налево (растёт отношение Э/О) и сверху вниз (у Э растут радиус и КЧ).
Немолекулярное строение имеют, к примеру, такие оксиды как:
-
- SO3 (цепочки из тетраэдров SO4, Э/О=3),
-
- P2O5 (слои из тетраэдров PO4, Э/О=2,5),
-
- SiO2 (трехмерный каркас из тетраэдров SiO4, Э/О=2).
SiO2 и, особенно, B2O3 легко переходят в некристаллическое (аморфное) состояние.
Каркасные оксиды химически наименее активны. Высокой активностью обладают молекулярные оксиды: SO2, Cl2O7.
23
