
- •Неметаллы
- •6. Физические свойства и строение неметаллов
- •7. Получение неметаллов
- •8. Химические свойства неметаллов.
- •9. Соединения неметаллов с водородом
- •10. Соединения неметаллов с кислородом
- •Строение и физические свойства оксидов
- •Получение и химические свойства оксидов
- •11. Кислородные кислоты и их соли
- •Соли кислородных кислот
- •Галогены. Общая характеристика
- •2. Галогены в природе. Получение галогенов.
- •Взаимодействие галогенов с водой.
- •11.1. Оксокислоты hxo и их соли.
- •11.2. Оксокислоты hxo2
- •11.3. Свойства кислот hxo3 и их солей.
- •11.4. Оксокислоты hxo4.
- •Материалы на основе галогенов и их соединений.
- •Фтор и его соединения
- •Физические свойства
- •Хлор и его соединения
- •Соединения хлора Хлористый водород
- •Химические свойства
- •Кислородсодержащие кислоты хлора
- •Бром и его соединения
- •Химические свойства
- •Бромистый водород hBr
- •Иод и его соединения
- •Химические свойства
- •Иодистый водород
- •Кислородные кислоты йода
Неметаллы
Принято делить химические элементы на металлы и неметаллы с учётом физических и химических свойств простых веществ.
Металлы обычно твёрдые, пластичные вещества, обладают характерным блеском, хорошо проводят тепло и электричество.
Неметаллы объединяет то, что электричество они проводят гораздо хуже, чем металлы. Отличие проявляется и в свойствах сложных веществ.
Неметаллы весьма разнообразны по свойствам. Углерод в форме графита – хороший проводник тепла и электричества, но, в отличие от металлов, хрупкий и не куётся. Твёрдые вещества с металлическим блеском: C, Si, As, I.
Неметаллы дают кислотные оксиды (например, CO2) или несолеообразующие оксиды (например, NO), в растворах они присутствуют обычно в виде анионных форм (например, S2– и SO42–).
Металлам в низких степенях окисления отвечают основные оксиды, основания и катионные формы в растворах (например, Fe2+).
В Периодической таблице можно провести условную границу между металлами и неметаллами. Она проходит по p-элементам от бора к астату. Неметаллы располагаются правее и выше этой границы. Обычно к ним относят 22 элемента: 6 инертных газов (от He до Rn), водород H и 5 галогенов (от F до At), 4 халькогена (от O до Te), в V группе: N, P, As, в IV группе: C, Si, в III группе: B. Условно водород иногда относят к VII группе.
В таблице указаны также относительные электроотрицательности элементов (ОЭО), характеризующие полярность связи и активность неметалла:
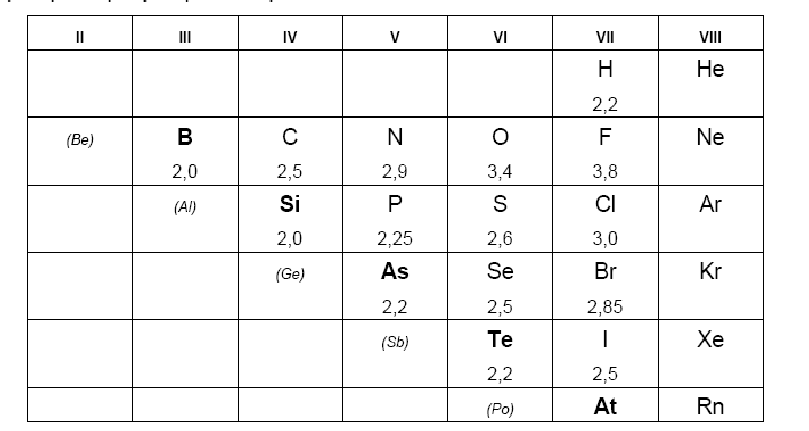
Все d-, f- и s-элементы (кроме водорода и гелия) – металлы.
-
6. Физические свойства и строение неметаллов
При 25°С и 1 атм He, Ne, Ar Kr, Xe, Rn – газы, состоящие из одноатомных молекул.
Из двухатомных молекул состоят галогены в газе (F2, Cl2), жидком состоянии (Br2) и в кристаллах (I2). Так как молекулы лёгкие и слабо взаимодействуют друг с другом, бром и йод легко испаряются. При обычных условиях двухатомными газами являются также водород, кислород и азот: H2, O2, N2.
Остальные неметаллы – твёрдые. Они могут существовать в формах (модификациях), отличающихся своим строением. Напомню, это явление называют полиморфизмом. Так, углерод известен в виде графита, алмаза и других форм, фосфор – в белой, красной, чёрной и других формах.
Модификации, имеющие молекулярное строение – обычно легкоплавкие, летучие, хорошо растворяются в неполярных органических растворителях: белый фосфор P4, жёлтый мышьяк As4, ромбическая сера S8, красный селен Se8.
Более прочны немолекулярные модификации. В серых селене и теллуре система химических связей распространяется в одном пространственном измерении (D=1), в графите, чёрном фосфоре и сером мышьяке D=2, в алмазе, кремнии и боре D=3. Увеличение D способствует снижению химической активности.
Химическая связь в простых веществах неметаллов: ковалентная, так как их атомы обладает высокой электроотрицательностью. Электроны соседних атомов создают общую электронную пару, а в пространстве между ядрами создаётся область повышенной электронной плотности.
Различают сигма-связь (σ-связь), когда эта область лежит на линии, соединяющей ядра, и пи связь (π-связь), когда она находится в стороне.
π-связь обычно менее прочна, чем σ-связь и образуется, когда линия ядро-ядро уже занята σ-связью. Если в соединении есть двойная связь, то одна из них σ-, другая π-. В случае тройной связи есть одна σ- и две π-связи.
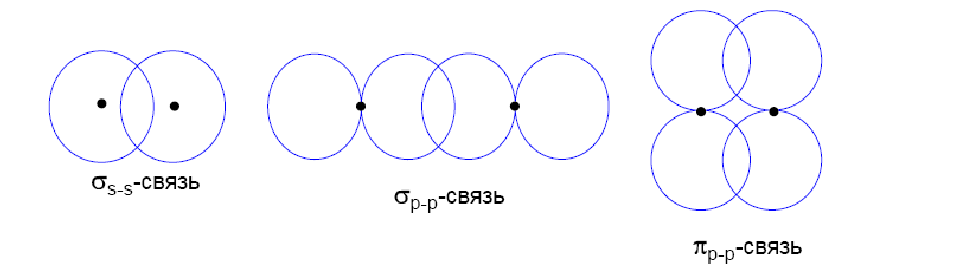
В большинстве неметаллов имеются только одинарные σ-связи. Наиболее прочными являются связи:
Наименее прочна связь F–F: 159 кДж/моль при длине 142 пм. Это одна из причин высокой химической активности фтора (наряду с молекулярным строением и большим сродством к электрону у атома).
В кислороде O2 – двойная связь, а в азоте N2 – очень прочная тройная (946 кДж/моль, 110 пм), что определяет его низкую реакционноспособность.
