
- •Рецензенты:
- •Коллигативные свойства растворов
- •Давление пара, содержащего нелетучее растворенное вещество, прямо пропорционально молярной доле растворителя.
- •Осмотическое давление и его измерение
- •Равновесию между раствором заданной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой, соответствует определённое гидростатическое давление в сосуде с раствором.
Осмотическое давление и его измерение
Прибор, применяемый для количественного изучения осмоса, называется осмометром. Простейший осмометр представляет собой сосуд 1, дно которого является полупроницаемой перегородкой. К сосуду приварен тонкий капилляр. Сосуд 1 содержит разбавленный раствор сахара. Полупрницаемая перегородка (дно сосуда 1) может пропускать только молекулы воды (но не молекулы сахара!). Если сосуд 1 опустить в стакан 2, заполненный водой, то молекулы воды будут диффундировать в сосуд 1, где концентрация молекул воды меньше, чем в стакане 2.
Сила (на единицу площади), заставляющая растворитель переходить через полупроницаемую перегородку в раствор (находящийся при том же внешнем давлении, что и растворитель), называется осмотическим давлением.
В следствии осмоса уровень раствора в сосуде 1 повышается,
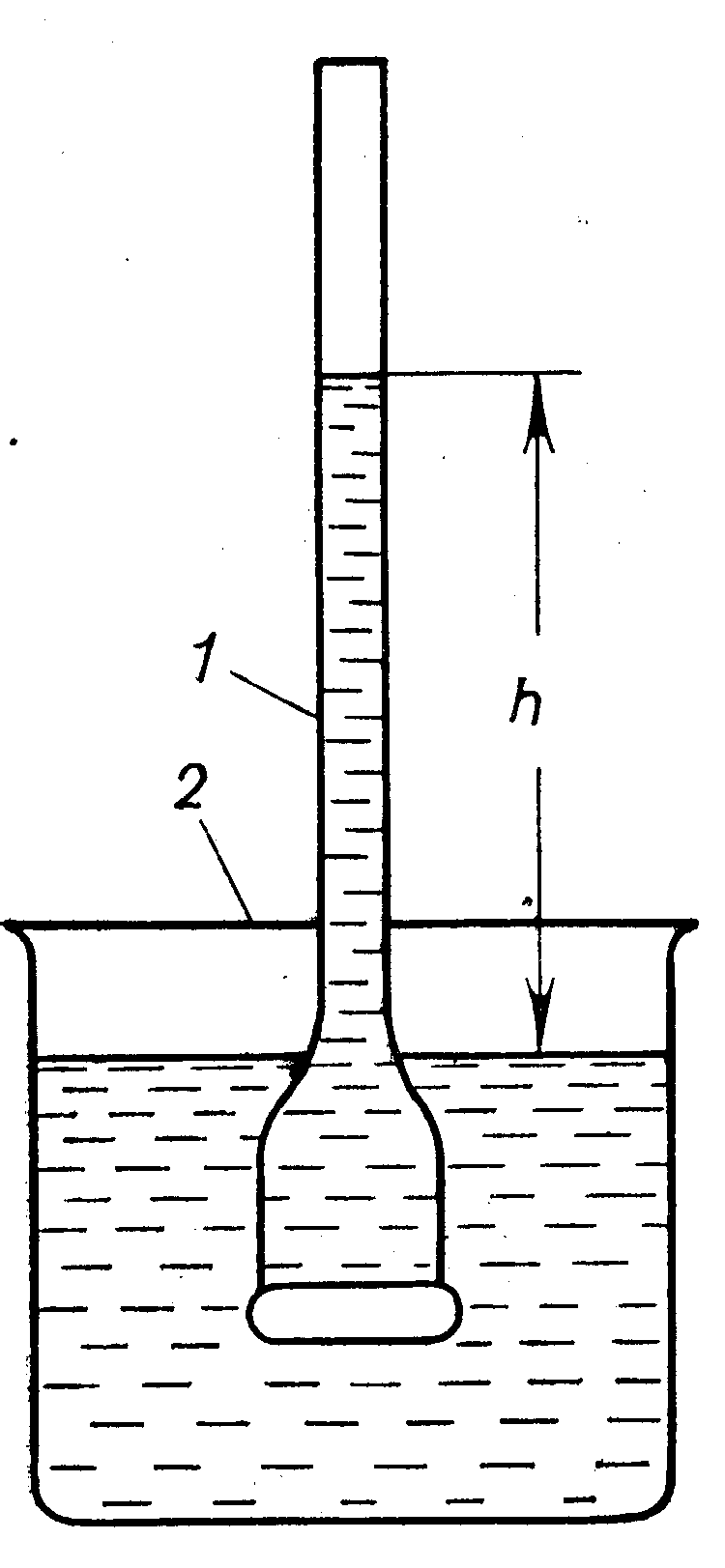
Рис 1.Простейший прибор для измерения осмотического давления: 1 – внутренний стакан; 2 – внешний стакан.
Вследствие осмоса уровень раствора в сосуде 1 повышается, создавая дополнительное давление, которое препятствует осмосу. При некоторой высоте h столба жидкости в сосуде 1 дополнительное давление достигает такой величины, при которой осмос прекращается. Устанавливается равновесие между раствором данной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой. Увеличивая извне давление в сосуде 1, можно заставить воду переходить из сосуда 1 во внешний сосуд 2. При этом концентрация раствора в сосуде 1 будет возрастать до тех пор, пока не достигнет значения, соответствующего увеличенному давлению; установится новое равновесие между раствором и растворителем.
Таким образом,
Равновесию между раствором заданной концентрации и чистым растворителем, разделёнными полупроницаемой перегородкой, соответствует определённое гидростатическое давление в сосуде с раствором.
Гидростатическое давление, равное высоте h, препятствующее односторонней диффузии растворителя, численно равно осмотическому давлению πосм раствора.
В 1887 г ботаник Пфеффер экспериментально установил две закономерности, которым подчиняется осмотическое давление неэлектролита.
1. В разбавленных растворах неэлектролита при данной температуре осмотическое давление прямо пропорционально концентрации
πосм = К1С
2. При одной и той же концентрации С (моль/л) осмотическое давление разбавленного раствора прямо пропорционально абсолютной температуре
πосм= К2С
Вант-Гофф обратил внимание на аналогию между законами Пфеффера и газовыми законами Гей-Люссака и Бойля-Мариотта. Анализируя числовые данные, он пришел к выводу, что величину осмотического давления можно вычислять по следующей формуле:
πосм = СRT,
где С – концентрация вещества в растворе, R – универсальная газовая постоянная, Т – абсолютная температура.
Это выражение носит название закона Вант-Гоффа для осмотического давления. Приведём формулировку закона, данную Вант-Гоффом:
Осмотическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворённое вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объём, равный объёму раствора.
Однако, несмотря на сходство с уравнением состояния идеальных газов, аналогия между осмотическим и газовым давлением случайна.
В биологических жидкостях (моча, плазма, слюна, молоко и др.) в больших количествах содержатся неорганические и органические вещества в виде молекул, ионов и коллоидных частиц. Их суммарная концентрация носит название осмотической концентрации (или осмолярности). и именно эта величина должна быть использована в уравнении Вант-Гоффа.
Осмолярная концентрация – суммарное молярное количество всех кинетически активных, т.е.э способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
Осмолярная концентрация раствора связана с его молярной концентрацией через изотонический коэффициент cосм =ic(x). Это очень важно учитывать при приготовлении физиологических растворов. Осмотические свойства тканей следует учитывать также и в медицине при внутривенных вливаниях лекарств. Вводимый раствор не должен быть токсичным, а кроме того, необходимо, чтобы его осмотическое давление было таким же, как у кровяной плазмы, иначе говоря, вводимый раствор должен иметь такое же осмотическое давление. Например, так называемый физиологический раствор, который можно вводить человеку внутривенно в больших количествах, является изотоническим раствором хлорида натрия. При приготовлении физиологических растворов необходимо учитывать их осмотические свойства.
Роль осмотических явлений в различных физиологических процессах чрезвычайно велика. Постоянство осмотического давления (изоосмия) тех или иных физиологических сред (плазма, внутриклеточная жидкость, моча и т.д.) представляют собой фундаментальное физико-химическое требование гомеостаза. Осмотическое давление плазмы крови человека составляет около 8 атмосфер, у рыб ≈ 15, у отдельных растений может достигать 100, а у прорастающих семян – до 400 атмосфер. Столь высокие значения осмотического давления достигаются за счёт суммарного эффекта растворённых неорганических веществ. В плазме наиболее значимым компонентом является NaCl.
На долю ВМС – белков – приходится незначительная часть от общего давления, называемая онкотическим давлением. Величина онкотического давления крови, вызываемого альбуминами и глобулинами, составляет 0,03 – 0,04 атм. Однако эта незначительная составляющая от общего осмотического давления играет принципиальную роль в некоторых физиологических процессах.
Осмотический метод применим также для определения молекулярной массы высокомолекулярных соединений. Зависимость осмотического давления растворённого вещества от его концентрации описывается соотношением
πосм= gRT/M + A∙g2
или
πосм/g = RT/M + A∙g
где g – масса вещества в граммах, М – молярная масса полимера.
Для электролитов, в растворах которых при диссоциации молекул увеличивается число частиц, Вант-Гофф предложил использовать изотонический коэффициент i, который учитывает изменение числа частиц в растворе. Физический смысл этого коэффициента следующий:
i = число всех частиц в растворе/число исходных частиц
Для растворов неэлектролитов i = 1, а для растворов электролитов вследствие диссоциации их молекул i > 1:
Электролит NaCl CaCl2 Na3PO4
I(максим.) = 2 3 4
Если в растворе идёт процесс ассоциации частиц, то i < 1.
Для растворов электролитов формулу Вант-Гоффа записывают так: πосм= iCRT.
Если у двух растворов осмотическое давление одинаковое, то эти растворы называются изотоническими и между ними происходит подлинно равновесный обмен молекулами растворителя.
Если в контакте два раствора с разными πосм , то раствор с большим πосм называют гипертоническим, а с меньшим πосм - называют гипотоничсеским. Гипертонический раствор будет всасывать растворитель из гипотонического вследствие стремления к выравниванию концентрации веществ за счёт перераспределения растворителя между этими растворами.
Осмотическая ячейка – это система, отделённая от окружающей среды мембраной с избирательной проницаемостью. Все клетки живых существ – осмотические ячейки.
Явление движения растворителя из окружающей среды в осмотическую ячейку называют эндосмосом.
Условия эндосмоса: Свнутр. > Снаруж.; πосм(внутр.) > πосм(наруж.).
В результате эндосмоса вода диффундирует в клетку, происходит набухание клетки с появлением напряженного состояния клетки, называемого тургор. В растительном мире тургор помогает растению сохранять вертикальное положение и определённую форму.
Если разница в концентрациях наружного и внутреннего раствора достаточно велика, а прочность оболочки клетки небольшая, то эндосмос приводит к разрушению клеточной мембраны и лизису клетки. (Напомним, что лизис это разрушение, распад, растворение клеток).
Эндосмос является причиной гемолиза (гематолиза) – разрушения эритороцитов крови с выделением в окружающую среду гемоглобина. В норме гемолиз завершает жизненный цикл эритроцитов (приблизительно 125 суток) и происходит в организме человека и животных непрерывно. Патологический гемолиз происходит под влиянием гемолитических ядов, холода, некоторых лекарственных веществ и других факторов.
Кроме эндосмоса возможен экзосмос:
экзосмос – это движение растворителя из осмотической ячейки в окружающую среду.
Условия экзосмоса: Снаруж.> Свнутр.; πосм(наруж.) > πосм(внутр.).
В результате экзосмоса вода диффундирует из клетки в плазму и происходит сжатие и сморщивание оболочки клетки, называемое плазмолизом. Экзосмос имеет место, если клетка оказывается в гипертонической среде. Явление экзосмоса наблюдается, например, при посыпании ягод или фруктов сахаром, а овощей, мяса, рыбы – солью. При этом происходит консервирование продуктов питания благодаря уничтожению микроорганизмов вследствии их плазмолиза.
Любое нарушение осмотического давления в тканях вызывает различные заболевания (так, например, отёки связаны с нарушением осморегуляции).
Временные нарушения осмотических свойств тканей вызывают различные физиологические ощущения. Например, чувство жажды, возникающее после приёма большого количества солёной пищи, связано с тем, что при этом возрастает содержание солей в клеточном соке организма. Потребность организма в воде для уменьшения осмотического давления тканевых растворов проявляется в виде чувства жажды. Известно, что в период сильной жары туристам и солдатам во время походов, а также рабочим горячих цехов дают солёное питьё (а ещё лучше поваренную соль). Этот, на первый взгляд, парадокс объясняется весьма просто. При сильной жаре с потом из организма удаляется значительное количество солей. Поскольку содержание солей в поте выше, чем в клеточном соке тканей человека, это приводит к нарушению осморегуляции, и осмотическое давление тканей становится ниже нормального. Однако организм на любое отклонение (как на повышение, так и на понижение осмотического давления) отвечает одинаковой реакцией – чувством жажды. Человек пьёт воду, но она только усиливает жажду. Чтобы избавиться от жажды, надо увеличить осмотическое давление тканей, то есть ввести в них не воду, а дополнительное количество солей.
Основную задачу осморегуляции выполняют почки. Осмотическое давление мочи в норме значительно выше, чем плазмы крови, что обеспечивает активный транспорт из крови в почку. Осморегуляция осуществляется под контролем ферментативных счистем. Нарушение их деяте
льности приводит к патологическим процессам. Так, например, при нефрите осмотическое давление у мочи может оказаться ниже, чем у крови, что вызовет обратный транспорт веществ.
Роль осмоса и осмотического давления
в биологических системах.
1. Осмос регулирует поступление воды в клетки и межклеточные структуры. Если бы вода просачивалась в ткани, то это вызывало бы отек различных органов и подкожной живой клетки. Это наблюдается при механических повреждениях различных органов.
2. Упругость клеток (тургор), эластичность тканей, сохранение определенной формы органов обусловлены осмотическим давлением. Клетки некоторых растений развивают давление 4-20 атм. Прорастающие ростки деревьев поднимают асфальт.
3. Растворы, имеющие одинаковое осмотическое давление называются изотоническими. Например, используются в медицине такие растворы как 0,9%-ный р-р NaCl и 5%-ный р-р глюкозы, которые изотоничны крови (т.е. имеют такое же осмотическое давление). Растворы с более высоким осмотическим давлением называются гипертоническими, а с более низким – гипотоническими.
Осмотическое давление плазмы крови человека при 370С составляет около 7,6 атм, это давление создает электролитный состав крови: 60% этого давления создает NaCl, затем глюкоза и др. Часть осмотического давления (около 0,03 атм) обусловлено белками (альбумины). Это давление называется онкотическим.
4. Помещая клетку в дистиллированную воду, наблюдается эндосмос (молекулы воды проникают во внутрь клетки), происходит набухание, а затем и разрыв оболочки и вытекание клеточного содержимого. Это явление называется лизисом. В случае эритроцитов – гемолизом.
В концентрированных растворах солей отмечается сморщивание клеток - плазмолис, связанный с потерей воды, или экзосмосом.
5. Человеческий организм характеризуется постоянством осмотического давления, колебания его незначительны. Поэтому при различных процедурах в кровь человека в больших количествах можно вводить только изотонические растворы. При больших потерях крови (операции, травмы) больным вводят по несколько литров изотонического раствора NaCl (0,9%) для возмещения потери жидкости с кровью. Но следует помнить, что изотонический раствор кровь не заменяет!
6. В хирургии применяют гипертонические растворы, например 10%-ный р-р NaCl. Смоченную в таком растворе повязку накладывают на рану для очистки от гноя, микроорганизмов и продуктов распада.
7. Горькая соль MgSO4 *7H2O и глауберова соль Na2SO4*10 H2O являются сильными слабительными средствами. Это их свойство основано на осмосе: эти соли плохо всасываются желудочно-кишечном тракте, гипертонические растворы MgSO4 *7H2O и Na2SO4*10 H2O заставляют устремляться в просвет кишечника большое количество воды, что приводит к послабляющему эффекту.
8. Почка – эффективный осмотический аппарат. Основная функция ее заключается в удалении продуктов обмена из крови: в более концентрированный раствор – мочу - через полупроницаемую мембрану.
9. Одним из основных механизмов поступления минеральных веществ в эмаль зубов следует считать осмотическое давление. Если эмаль покрыть высококонцентрированным раствором сахара, то осмотическое давление достигает 50 атм. Поэтому малые по размеру ионы, включая Н+, будут интенсивно проникать в эмаль, что в конечном итоге приведет к кариесу.
Вопросы для самоконтроля.
-
Перечислите коллигативные свойства раствора.
-
Какой раствор называется идеальным.
-
Сформулируйте первый закон Рауля.
-
Сформулируйте второй закон Рауля.
-
Что такое осмос.
-
Сформулируйте закон Закон Вант-Гоффа.
-
Что называется осмотическим давлением.
-
Что называется экзоосмосом и эндоосмосом.
-
Роль осмоса и осмотического давления в биологических системах.
-
Чему равно осмотическое давление 0,5М раствора глюкозы при 250С?
-
Вычислите осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 мл Н2О при 293 К. плотность раствора принять за единицу. Ответ: 311 кПа.
-
К 100 мл 0,5М раствора сахарозы С12Н22О11 добавили 300 мл Н2О. Чему равно осмотическое давление полученного раствора при 250С?
Ответ: 309,6 кПа.
Тесты для самоконтроля
Вариант 1
-
Если ∆Н растворения меньше нуля – это процесс:
а) эндотермический, б) экзотермический,
в) сбалансированный, г) атермический.
-
Каково осмотическое давление в кПа раствора пиридина (М = 80 г/моль), содержащего 4 г вещества в 2 л раствора (t=00С)?
а) 28,37, б) 40,12, в) 48,24, г) 56,74.
-
Факторы, свидетельствующие о химизме процесса растворения?
а) диффузия, б) тепловой эффект,
в) контракция, г) изменение окраски раствора.
-
Неограниченно смешиваются друг с другом?
а) вода + бензол, б) вода + этиловый спирт,
в) вода + сахароза, г) гексан + гептан.
-
Какой из водных растворов имеет самое высокое осмотическое давление, если в их равных объёмах содержатся одинаковые массы следующих веществ?
а) СН3ОН, б) С3Н8О3, в) С2Н5ОН, г) СН3СОСН3
