
Электропроводность электролитов
Сопротивление R
(Ом) любого проводника, в том числе и
электролита, зависит от его природы,
сечения S (см2),
по которому течет ток, и длины
![]() (см).
(см).
![]() (1)
(1)
где
![]() – коэффициент пропорциональности,
называемый удельным сопротивлением
(очевидно, если
– коэффициент пропорциональности,
называемый удельным сопротивлением
(очевидно, если
![]() = 1 см и S = 1 см2,
то R =
= 1 см и S = 1 см2,
то R =
![]() ).
).
Удельное
сопротивление
– сопротивление проводника сечением
1 см2
и длиной 1 см, т.е. это сопротивление 1
см3
или для раствора – 1 мл.
![]() имеет размерность (Ом *
см).
имеет размерность (Ом *
см).
Электропроводность
– величина, обратная сопротивлению.
Удельная электропроводность![]()
![]() (каппа)
равна
(каппа)
равна
![]() .
.
![]() =
=
![]() (Ом-1
* см-1) (2)
(Ом-1
* см-1) (2)
Электрический ток
в растворе переносится ионами. Чем
больше ионов в растворе, чем большее их
число содержится в 1 см3,
тем больше удельная электропроводность
![]() .
.
Для определения
![]() нужно согласно выражению (1) найти
сопротивление R и, зная
нужно согласно выражению (1) найти
сопротивление R и, зная
![]() и S
проводника, вычислить 1/
и S
проводника, вычислить 1/![]() =
=
![]() .
Но изготовление сосуда с электродами,
для которого
.
Но изготовление сосуда с электродами,
для которого
![]() и S
были бы точно известны, технически
трудно. Поэтому применяют сосуды, удобные
в изготовлении и работе, но с неизвестными
и S
были бы точно известны, технически
трудно. Поэтому применяют сосуды, удобные
в изготовлении и работе, но с неизвестными
![]() и S.
и S.
Н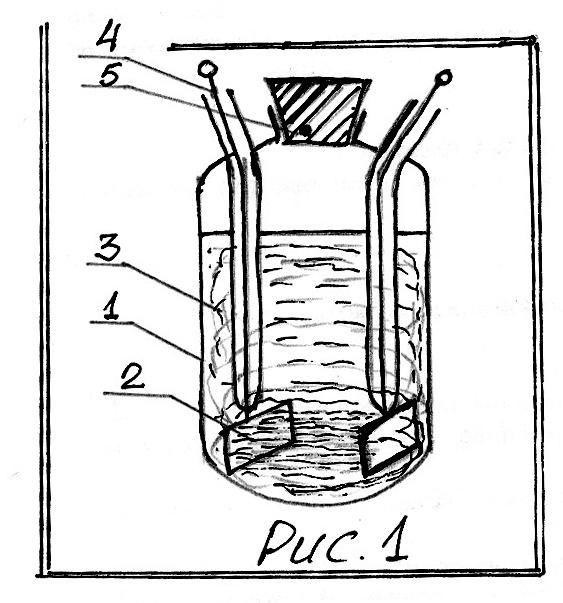 а
рис.1 представлена схема сосуда,
применяемого для определения
а
рис.1 представлена схема сосуда,
применяемого для определения
![]() (сосуд Аррениуса), где
(сосуд Аррениуса), где
1. стеклянный сосуд;
2. Pt-электроды;
3. электролит;
4. токоподводы в стеклянных трубках;
5. пробка.
На рис.1 представлена
также схема распределения тока между
двумя Pt-электродами, помещенными в сосуд
с электролитом. Ток проходит не по
кратчайшему пути от электрода к электроду.
Поэтому невозможно найти величину
![]() /S,
определяющую сопротивление.
/S,
определяющую сопротивление.
Поэтому при
определении электропроводности в таких
сосудах отношение
![]() /S
рассматривают как постоянную величину,
характерную для сосуда данных размеров
и формы при данном расположении электродов
и постоянном объеме раствора (в нашем
случае – 20 мл).
/S
рассматривают как постоянную величину,
характерную для сосуда данных размеров
и формы при данном расположении электродов
и постоянном объеме раствора (в нашем
случае – 20 мл).
Тогда R =
![]() или
или
![]() (3)
(3)
Величина K называется постоянной сосуда, или емкостью сопротивления сосуда, т.к. показывает сколько удельных сопротивлений содержится в сосуде с сопротивлением R (см.(3)).
Формула (3), с учетом,
что
![]() = 1/
= 1/![]() , принимает вид:
, принимает вид:
K
=
![]() R (4).
R (4).
Для определения
опытным путем K используют электролит,
![]() для которого известно. Обычно это 0,1 М
раствор KCl,
для которого
для которого известно. Обычно это 0,1 М
раствор KCl,
для которого
![]() при 25°C равна 0, 01288 Ом-1см-1.
при 25°C равна 0, 01288 Ом-1см-1.
Измерение сопротивления R проводятся при помощи моста сопротивления, питаемого переменным током (рис.2).
R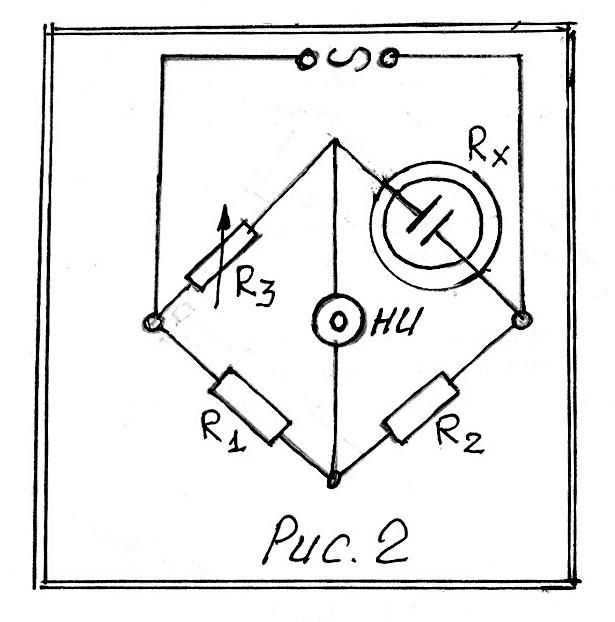 x
–
измеряемое сопротивление;
x
–
измеряемое сопротивление;
R1, R2, и R3 – изменяемые сопротивления;
НИ – индикатор.
Условие баланса моста может быть представлено пропорцией (5):
![]() (5)
(5)
Отсюда искомая величина Rх вычисляется как
Rх=
R3![]() (6)
(6)
В случае, если R2 = R1, Rx = R3.
Электропроводность
электролита зависит от его концентрации,
а последняя не фигурирует в формуле для
расчета
![]() ,
т.к. удельная электропроводность – это
электропроводность 1 см3
раствора. Поэтому для понимания свойств
электролитов
,
т.к. удельная электропроводность – это
электропроводность 1 см3
раствора. Поэтому для понимания свойств
электролитов
![]() представляет величину мало удобную.(Но
зато ее можно получить непосредственным
измерением).
представляет величину мало удобную.(Но
зато ее можно получить непосредственным
измерением).
Пересчитав
![]() ,
можно найти величину, связанную с
концентрацией электролита – эквивалентную
электропроводность λ (лямбда),
которую ввел в науку Э.Х.Ленц.
,
можно найти величину, связанную с
концентрацией электролита – эквивалентную
электропроводность λ (лямбда),
которую ввел в науку Э.Х.Ленц.
На рис.3 представлена
схема, поясняющая связь между удельной
(![]() )
и эквивалентной (λ) электропроводностью.
)
и эквивалентной (λ) электропроводностью.
Допустим, что имеем
произвольный объем раствора, в котором
содержится 1 г-экв электролита. Поместим
мысленно этот раствор в плоский сосуд
шириной 1 см. Противоположные стенки
его (А и В на рис.3) сделаны и з
листовой платины. Прочие размеры таковы,
что залитый в этот сосуд раствор содержит
1 г-экв растворенного вещества.
з
листовой платины. Прочие размеры таковы,
что залитый в этот сосуд раствор содержит
1 г-экв растворенного вещества.
Объем раствора в
плоском сосуде, например, n см3.
Каждый из n кубиков в сосуде (см. рис.3)
имеет электропроводность
![]() (удельную). Ток проходит между поверхностью
А и В. Следовательно, все кубики включены
параллельно.
(удельную). Ток проходит между поверхностью
А и В. Следовательно, все кубики включены
параллельно.
Суммарная электропроводность n кубиков:
λ = n
![]() (7).
(7).
Каждый кубик содержит 1/n г-экв, т.е. концентрация раствора С составляет (в г-экв/мл):
![]() (8)
(8)
Поэтому уравнение (7) можно переписать, выразив λ в (Ом-1 * см2), так
λ =![]()
![]() (9)
(9)
или, переходя от (мл) к (л), заменим С на С0 (г-экв/л):
λ =![]()
![]() (10)
(10)
Если бы выбранный объем раствора содержал 1 моль растворенного вещества, то мы бы имели молярную электропроводность μ (мю). Соотношение (10) осталось бы неизменным, только С0 представляло бы концентрацию в молях на 1 л.
λ при разбавлении раствора может только возрастать, т.к. разбавление увеличивает степень диссоциации (α) вещества на ионы и при данном количестве растворенного вещества (1 г-экв) в объеме раствора растет абсолютное число ионов.
П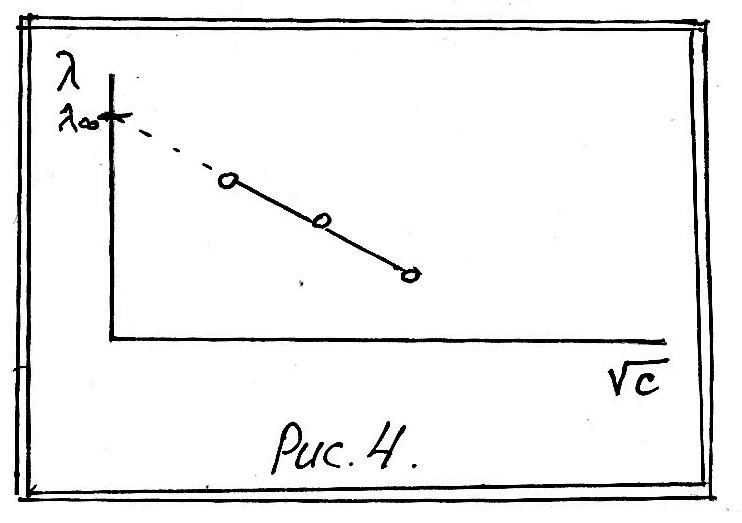 редельное
значение λ при α=1 называется эквивалентной
электропроводностью
при бесконечном
разбавлении
и обозначается λ∞. Для нахождения λ∞
проводят определение
редельное
значение λ при α=1 называется эквивалентной
электропроводностью
при бесконечном
разбавлении
и обозначается λ∞. Для нахождения λ∞
проводят определение
![]() для ряда последовательно убывающих
концентраций, вычисляют для них значения
λ, наносят на график в координатах λ –
√C
и экстраполяцией определяют λ∞ (рис.4).
для ряда последовательно убывающих
концентраций, вычисляют для них значения
λ, наносят на график в координатах λ –
√C
и экстраполяцией определяют λ∞ (рис.4).
Одним из основных, в сущности, недоказанных положений теории электролитической диссоциации было утверждение, что степень диссоциации α равна отношению электропроводности λ при данном разбавлении (для которого определяется λ) к λ∞
α =![]() (11)
(11)
В этом случае α представляет собой коэффициент электропроводности.
Примечание: Степенью диссоциации α называется отношение числа молекул, распавшихся на ионы, к общему числу молекул, введенных в раствор. Так, если в раствор было введено n2 молекул (или молей), а на ионы из них распалось (продиссоциировало) n' молекул (или молей), то степень диссоциации
α =![]() (12)
(12)
Очевидно, что степень диссоциации α может меняться от нуля (диссоциации нет) до 1 (полная диссоциация)
0 ≤ α ≤ 1
Степень диссоциации α зависит от природы растворенного вещества и растворителя, а также от концентрации раствора.
По теме «Электропроводность растворов электролитов» выполняется две лабораторные работы. Работа № 1 посвящена определению удельной и эквивалентной электропроводности растворов. Работа № 2 дает возможность с помощью метода кондуктометрического титрования определить концентрацию раствора электролита.
Работа № 1
Определение электропроводности раствора электролита
Для работы необходимо иметь:
– сосуд Аррениуса;
– мерная колба (100 мл);
– 2 пипетки на 10 и 20 мл;
– стеклянный стаканчик;
– воронка;
– термостат на 25°C;
– аналитические весы;
– мост переменного тока;
– дистиллированная вода.
Порядок проведения работы
1. Получить сосуд Аррениуса у лаборанта, вылить из него дистиллированную воду, залить в него 20 мл 0,1 н раствора KCl, поместить сосуд в термостат на 25°C.
2. Получить у лаборанта соль для приготовления раствора электролита заданной концентрации.
Рассчитать навеску для приготовления раствора.
Пример расчета навески.
Допустим, требуется
приготовить 100 мл раствора, содержащего
1/32
г-экв/л соли. Если эквивалент соли
равен M/z (г), где M – молекулярная масса
соли, а z – суммарная валентность катиона
или аниона (для NaCl
z = 1; для CuSO4
z = 2 и т.п.),
то в 100 мл содержится
![]() г
или
г
или
![]() для концентрации 1/32 г-экв/л.
для концентрации 1/32 г-экв/л.
Так, для NaCl M = 23 + 35,5 = 58,5 г. z = 1. Величина навески:
X=
![]() =0,1828
г.
=0,1828
г.
Для CuCl2 М = 64 + 71 = 135 г; z = 2
Х=![]() =0,211
г.
=0,211
г.
Взвешивание навески производится на аналитических весах с точностью как минимум до 3-го знака после запятой.
3. Перенести навеску с помощью воронки в мерную колбу на 100 мл, залить в колбу примерно 30 мл дистиллированной воды, в которой полностью растворить навеску соли, после чего долить воды до 100 мл.
4. Измерить с помощью моста переменного тока, подключив к нему сосуд Аррениуса, сопротивление раствора 0,1 н KCl. Измерения проводить несколько раз так, чтобы последние два измеренных сопротивления были одинаковыми. Если R = const, значит, сосуд нагрелся до 25°C.
5. Определив сопротивление 0,1 н KCl, рассчитать постоянную сосуда К.:
K=
![]()
![]() *Rизм=0,01288*Rизм
*Rизм=0,01288*Rизм
Полученное значение К показать преподавателю.
6. Вылить из сосуда Аррениуса, отсоединив от него провода, раствор KCl, сполоснуть сосуд дистиллированной водой и раствором задачи. Залить с помощью стаканчика и пипетки на 20 мл в сосуд 20 мл исследуемого раствора и поместить сосуд в термостат на 25°C.
7. Через 5 минут провести первое измерение R раствора и далее измерять через 3 – 5 мин. Повторять измерения до достижения постоянства R.
8. Рассчитать
![]() и λ для заданного
раствора:
и λ для заданного
раствора:
![]() =
=![]() ;
λ=
;
λ=![]() .
.
Показать результат преподавателю.
9. Приготовить вторую концентрацию раствора. Если первая С1 = 1/32 моля, а вторая С2 = 1/64 моля, то надо из сосуда Аррениуса с помощью пипетки на 10 мл оттянуть 10 мл раствора первой концентрации и, промыв пипетку на 10 мл дистиллированной водой, добавить в сосуд Аррениуса 10 мл воды.
10. Сосуд снова помещают в термостат на 25°C и проводят измерения R для второй концентрации так же, как в п.7.
11. Рассчитать
![]() и λ для концентрации
1/64 моля и показать результат преподавателю.
Работа окончена.
и λ для концентрации
1/64 моля и показать результат преподавателю.
Работа окончена.
12. Вылить из сосуда Аррениуса раствор, залить в него дистиллированную воду, вымыть использованную посуду и сдать лаборанту рабочее место.
В отчете должно быть:
– теоретическая часть;
– схемы прибора и сосуда;
– расчеты К,
![]() ,
λ и α = λ/ λ∞, а также
график λ–√C
для определения λ∞.
,
λ и α = λ/ λ∞, а также
график λ–√C
для определения λ∞.
