
Правило Гунда
При данном значении l (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Если, например, в трех p-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных p-орбиталях:
![]()
В этом случае суммарный спин равен 3/2 , поскольку его проекция равна ms = +1/2+1/2+1/2=3/2 . Эти же три электрона не могут быть расположены таким образом:
![]()
потому что тогда проекция суммарного спина ms = +1/2-1/2+1/2=1/2 .
Принцип наименьшей энергии
В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
Энергия электрона в основном определяется главным квантовым числом n и побочным квантовым числом l, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел n и l является наименьшей. Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d, так как в первом случае n + 1 = 4 + 0 = 4, а во втором n + l = 3 + 2 =5; на подуровне 5s (n + l = 5 + 0 = 5) энергия меньше, чем на 4d (n + l = 4 + 2 = 6); на 5р (n + l = 5 + 1 = 6) энергия меньше, чем на 4f (n + l = 4 + 3 = 7) и т.д.
В.М. Клечковский впервые в 1961 г. сформулировал общее положение, гласящее, что электрон занимает в основном состоянии уровень не с минимальным возможным значением n, а с наименьшим значением суммы n + l.
В том случае, когда для двух подуровней суммы значений n и l равны, сначала идет заполнение подуровня с меньшим значением n. Например, на подуровнях Зd, 4р, 5s сумма значений n и l равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями n, т.е. Зd - 4р – 5s и т.д. В периодической системе элементов Менделеева последовательность заполнения электронами уровней и подуровней выглядит следующим образом

Следовательно, согласно принципу наименьшей энергии во многих случаях электрону энергетически выгоднее занять подуровень «вышележащего» уровня, хотя подуровень "нижележащего" уровня не заполнен
И менно
поэтому в четвертом периоде сначала
заполняется подуровень 4s и
лишь после этого подуровень Зd.
менно
поэтому в четвертом периоде сначала
заполняется подуровень 4s и
лишь после этого подуровень Зd.
Следующий элемент этого периода — 24Сr. На основании трех основных положений — принципа Паули, правила Гунда и принципа наименьшей энергии — его электронную конфигурацию можно представить так

хотя на самом деле у атома 24Cr обнаружены некоторые аномалии и действительная его электронная конфигурация несколько иная.
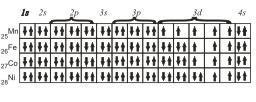
Для атомов Mn, Fe, Со и Ni электронные конфигурации будут следующие
Наконец, последние восемь элементов четвертого периода имеют конфигурации

Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов, если при этом не нарушается принцип Паули.
Наряду с химическими реакциями, в которых принимают участие только электроны, существуют различные превращения, в которых изменению подвергаются ядра атомов (ядерные реакции).
Ранее было отмечено, что в состав ядра атомов входят протоны и нейтроны. В настоящее время известно, что строение ядра более сложное. Здесь и в дальнейшем будем рассматривать ядро, состоящее из протонов и нейтронов.
Выше введено и понятие изотопа; подчеркнем, что все изотопы данного элемента имеют одинаковое число протонов, а, следовательно, все они обладают одним и тем же атомным номером Z (Z определяется именно количеством протонов в ядре).
Согласно современным представлениям химическим элементом называют вид атомов, характеризующихся одним и тем же зарядом ядра.
Протон
обладает массой 1,0073 а.е.м. и зарядом +1
(за единицу электрического заряда
принимается заряд электрона). Масса
нейтрона равна 1,0087 а.е.м., заряд— 0.
Обозначение изотопа включает в себя
массовое число, т.е. атомную массу (равную
сумме протонов и нейтронов — иногда
эту сумму также называют нуклонным
числом или
просто нуклоном
)
и порядковый номер (равный числу протонов
в ядре). Атомная масса изотопа обычно
записывается сверху слева от символа
элемента, порядковый номер — снизу
слева, например: ![]()
Эта
форма записи распространяется и на
элементарные частицы: β-лучи, представляющие
собой электроны, имеют ничтожно малое
массовое число и им приписывают массовое
число, равное 0. Поэтому β-частицы
обозначаются символом ![]() .
α-частицы (положительные двухзарядные
ионы гелия) обозначают символом
.
α-частицы (положительные двухзарядные
ионы гелия) обозначают символом ![]() ,
а нейтрон и протон — соответственно
,
а нейтрон и протон — соответственно ![]() и
и ![]() .
.
Обычно
изотопы различных элементов не имеют
специальных названий. Единственным
исключением является водород, изотопы
которого имеют специальные химические
символы и названия: ![]() —
протий,
—
протий, ![]() —
дейтерий,
—
дейтерий, ![]() —
тритий. Это связано с тем, что относительное
отличие масс изотопов для водорода
является максимальным.
—
тритий. Это связано с тем, что относительное
отличие масс изотопов для водорода
является максимальным.
