
- •Глава 1 введение
- •§ 1.1. История развития энергетики и современное ее состояние
- •§ 1.2. Техническая термодинамика как теоретическая основа теплоэнергетики
- •§ 1.3. Краткий исторический очерк развития термодинамики
- •Контрольные вопросы
- •Глава 2 первый закон термодинамики. Основные понятия и определения
- •§ 2.1. Термодинамическая система и окружающая среда
- •§ 2.2. Основные термодинамические параметры состояния
- •§ 2.3. Термодинамический процесс
- •§ 2.4. Уравнение состояния
- •§ 2.5. Уравнения состояния реальных газов
- •3) Область перегретого пара, расположенную правее кривой вк и выше точки к.
- •§ 2.6. Термические коэффициенты и связь между ними
- •§ 2.7. Энергия. Внутренняя энергия
- •§ 2.8. Теплота и работа
- •§ 2.9. Первый закон термодинамики
- •§ 2.10. Применение дифференциального исчисления функций многих переменных в термодинамике
- •§ 2.11. Теплоемкость
- •Контрольные вопросы
- •Глава 3 второй закон термодинамики
- •§ 3.1. Энергия и энтропия
- •§ 3.2. Равновесность и обратимость процессов
- •§ 3.3. Условия работы тепловых машин
- •§ 3.4. Цикл карно
- •§ 3.5. Обратный обратимый цикл карно
- •§ 3.6. Метод циклов. Открытие энтропии как функции состояния
- •§ 3.7. Общая математическая формулировка второго закона термодинамики
- •§ 3.8. Физический смысл и свойства энтропии
- •1. Энтропия является мерой потери работоспособности системы вследствие необратимости реальных процессов.
- •§ 3.9. Статистический смысл второго закона термодинамики
- •§ 3.10. Обобщенный термодинамический цикл карно. Регенерация теплоты
- •§ 3.11. Эксергетический метод исследования
- •§ 3.12. Эксергия рабочего тела
- •§ 3.13. Эксергия потока рабочего тела
- •§ 3.14. Эксергия теплоты
- •Контрольные вопросы
- •Глава 4 термодинамические процессы изменения состояния идеального газа
- •§ 4.1. Общие вопросы исследования процессов
- •§ 4.2. Изохорный процесс
- •§ 4.3. Изобарный процесс
- •§ 4.4. Изотермический процесс
- •§ 4.5. Адиабатный процесс
- •§ 4.6. Политропный процесс
- •Глава 5 характеристические функции и термодинамические потенциалы.
- •§ 5.1. Свойства характеристических функций
- •§ 5.2. Дифференциальные уравнения термодинамики
3) Область перегретого пара, расположенную правее кривой вк и выше точки к.
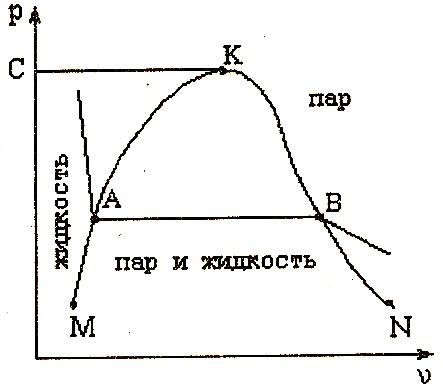
Рис. 2.3а
МК – кривая кипящей жидкости;
NK – кривая сухого пара
Условно область жидкости ограничивают сверху линией СК, представляющей собой критическую изобару.
Критическое состояние вещества впервые было открыто Д.И.Менделеевым в 1861г. Критическую температуру он назвал абсолютной температурой кипения, при которой поверхностное натяжение в жидкости становится равным нулю и исчезает различие между жидким и парообразным состоянием вещества. До открытия критического состояния вещества многие газы безуспешно пытались превращать в жидкость одним только увеличением давления. Однако, как это следует из рис. 2.3а, при температурах выше критических жидкое состояние вещества отсутствует. Поэтому для превращения газа в жидкость путем увеличения давления необходимо этот газ охладить до температуры ниже критической. Только после этого сжатием по изотерме любой газ можно превратить в жидкость.
При больших плотностях уравнение Ван-дер-Ваальса дает значительные ошибки, связанные с тем, что при его выводе не учитывались явления силовой ассоциации и диссоциации молекул под влиянием межмолекулярных сил взаимодействия. Кроме того, опытами было доказано, что коэффициенты а и b, входящие в уравнение Ван-дер-Ваальса, описываются достаточно сложными зависимостями от температуры и давления.
Русские ученые М.П.Вукалович и И.И.Новиков в 1939 г. предложили новое универсальное уравнение состояния реального газа, учитывающее явление силовой ассоциации молекул, которое имеет вид
![]()
где а и b - постоянные уравнения Ван-дер-Ваальса; С, m - постоянные, определяемые на основе опытов.
§ 2.6. Термические коэффициенты и связь между ними
Термические коэффициенты характеризуют тепловые и упругие свойства тел.
Известны коэффициент объемного расширения α, термический коэффициент давления β и изотермический коэффициент сжимаемости γ.
При нагревании определенной массы вещества при постоянном внешнем давлении изменение объема на каждый градус повышения температуры выражается частной производной (dV/dT)p. Относительное изменение объема при нагревании на один градус называется коэффициентом объемного расширения
![]() (2.11)
(2.11)
Для идеального газа α=1/Т.
Если температуру
выражать в градусах шкалы Цельсия, то
dt=dT
и относительное изменение объема
можно представить отношением производной
![]() к объему V0
при 0°С, т.е.
к объему V0
при 0°С, т.е.
![]()
Если принять, что в небольшом интервале изменения температур α0=const, то
![]()
Интегрируя последнее соотношение, приходим к выводу, что объем при изменении температуры изменяется по линейному закону
![]()
Для идеального газа при любом давлении
![]() 1/ 0C.
1/ 0C.
Если нагревать данную массу вещества при постоянном объеме, то относительное изменение давления при изменении температуры характеризуется величиной термического коэффициента давления β
![]() (2.12)
(2.12)
где р - давление при температуре Т.
Для идеального газа β=α=1/Т.
Аналогично (2.12) можно записать
![]()
При малом изменении температуры можно считать β0=const
![]()
После интегрирования получим p=p0(1+β0t).
Для идеального газа β0=α0.
При изотермическом сжатии данной массы вещества отношение изменения объема при изменении давления на одну единицу давления к объему называется изотермическим коэффициентом сжимаемости
![]() (2.13)
(2.13)
Знак минус означает уменьшение объема с увеличением давления.
Для идеальных газов по закону Бойля-Мариотта V=const/p (см. § 4.4). Дифференцируя по давлению, получим
![]()
Сравнивая последнее соотношение с (2.13), имеем γ=-1/р. Следовательно, коэффициент сжимаемости есть величина, обратная давлению.
Найдем взаимосвязь между термическими коэффициентами α, β и γ в общем случае. Полные дифференциалы давления, объема и температуры имеют вид (подробнее см. § 2.10)
![]()
![]()
![]()
Подставляя dp из первого уравнения во второе, с учетом того, что
![]()
получим
 (2.14)
(2.14)
Подставляя (2.11), (2.12), (2.13) в (2.14), будем иметь
![]() (2.15)
(2.15)
Последнее соотношение, связывающее все три термических коэффициента, позволяет найти один из них, если известны два других.
Так как для идеальных газов α=β=1/T, то из (2.15) следует, что γ =1/p.
Для жидких тел коэффициенты сжатия очень малы. Так для воды α0=0,000238, β=4,6.
Отсюда при нормальном давлении γ0=0,000052, тогда как для газа в этом случае γ0=1.
Следовательно, при увеличении давления на одну атмосферу (при t=const) объем воды убывает на 0,000052 доли первоначального объема.
