
- •Глава 1 введение
- •§ 1.1. История развития энергетики и современное ее состояние
- •§ 1.2. Техническая термодинамика как теоретическая основа теплоэнергетики
- •§ 1.3. Краткий исторический очерк развития термодинамики
- •Контрольные вопросы
- •Глава 2 первый закон термодинамики. Основные понятия и определения
- •§ 2.1. Термодинамическая система и окружающая среда
- •§ 2.2. Основные термодинамические параметры состояния
- •§ 2.3. Термодинамический процесс
- •§ 2.4. Уравнение состояния
- •§ 2.5. Уравнения состояния реальных газов
- •3) Область перегретого пара, расположенную правее кривой вк и выше точки к.
- •§ 2.6. Термические коэффициенты и связь между ними
- •§ 2.7. Энергия. Внутренняя энергия
- •§ 2.8. Теплота и работа
- •§ 2.9. Первый закон термодинамики
- •§ 2.10. Применение дифференциального исчисления функций многих переменных в термодинамике
- •§ 2.11. Теплоемкость
- •Контрольные вопросы
- •Глава 3 второй закон термодинамики
- •§ 3.1. Энергия и энтропия
- •§ 3.2. Равновесность и обратимость процессов
- •§ 3.3. Условия работы тепловых машин
- •§ 3.4. Цикл карно
- •§ 3.5. Обратный обратимый цикл карно
- •§ 3.6. Метод циклов. Открытие энтропии как функции состояния
- •§ 3.7. Общая математическая формулировка второго закона термодинамики
- •§ 3.8. Физический смысл и свойства энтропии
- •1. Энтропия является мерой потери работоспособности системы вследствие необратимости реальных процессов.
- •§ 3.9. Статистический смысл второго закона термодинамики
- •§ 3.10. Обобщенный термодинамический цикл карно. Регенерация теплоты
- •§ 3.11. Эксергетический метод исследования
- •§ 3.12. Эксергия рабочего тела
- •§ 3.13. Эксергия потока рабочего тела
- •§ 3.14. Эксергия теплоты
- •Контрольные вопросы
- •Глава 4 термодинамические процессы изменения состояния идеального газа
- •§ 4.1. Общие вопросы исследования процессов
- •§ 4.2. Изохорный процесс
- •§ 4.3. Изобарный процесс
- •§ 4.4. Изотермический процесс
- •§ 4.5. Адиабатный процесс
- •§ 4.6. Политропный процесс
- •Глава 5 характеристические функции и термодинамические потенциалы.
- •§ 5.1. Свойства характеристических функций
- •§ 5.2. Дифференциальные уравнения термодинамики
§ 3.5. Обратный обратимый цикл карно
Цикл Карно может протекать не только в прямом, но и в обратном направлении (см. рис. 3.4.).
Машины, работающие по обратному циклу, называются холодильными машинами. Это тепловые машины, которые создают и поддерживают разность температур путем отнятия теплоты у более холодного тела и передачи ее более горячему (см. глава 12). А такой процесс, как следует из формулировки второго закона термодинамики Клаузиуса, требует затраты энергии (не может совершаться без компенсации).

Рис. 3.4
Рассмотрим обратимый обратный цикл Карно, изображенный на рис. 3.4. В процессе 1-2 рабочее тело (холодильный агент) расширяется по адиабате с уменьшением температуры от T1 в точке 1 до Т2 в точке 2. Затем газ расширяется по изотерме 2-3 с подводом теплоты q2 от источника с температурой Т2. В адиабатном процессе сжатия 3-4 происходит увеличение температуры рабочего тела от Т2 до T1. В изотермическом процессе сжатия происходит отвод от рабочего тела теплоты q1 к верхнему источнику теплоты.
На осуществление обратного цикла в холодильной машине затрачивается удельная работа l. При этом от НИТ к ВИТ переносится количество теплоты, равное q2. Кроме того, к ВИТ передается теплота, равная затраченной работе l. Отсюда, вся теплота, получаемая ВИТ, будет q1=q2+l. Работа, затраченная на сжатие в процессах 3-4 и 4-1, больше работы расширения в процессах 1-2 и 2-3 на величину площади фигуры 1-2-3-4. Работа расширения производится сжатым газом, и она будет положительной. Работа сжатия производится над газом, и она будет отрицательной. Отсюда суммарная работа, затраченная на передачу теплоты от НИТ к ВИТ, будет отрицательной, и она будет равна l = q1 - q2. Эффективность работы холодильных машин характеризуется холодильным коэффициентом, определяемым в виде отношения теплоты, взятой, от НИТ и переданной ВИТ, к затраченной работе

Холодильный коэффициент характеризует эффективность передачи теплоты от НИТ к ВИТ. Он будет тем больше, чем большее количество теплоты q2 будет взято от НИТ и передано ВИТ и чем меньше будет на это затрачено работы l.
Холодильный коэффициент обратимого обратного цикла Карно определяется по формуле
![]()
Холодильный коэффициент этого цикла зависит лишь от абсолютных температур T1 и Т2 и имеет наибольшее значение по сравнению с холодильными коэффициентами любых других циклов, протекающих в тех же температурных пределах.
Холодильные машины, предназначенные для отопления помещений путем передачи теплоты от источника с более низкой температурой к источнику с более высокой температурой, называются тепловыми насосами.
Их эффективность оценивается отопительным коэффициентом φ, определяемым по формуле (см. § 12.5)
![]()
§ 3.6. Метод циклов. Открытие энтропии как функции состояния
В термодинамике большое распространение получил так называемый метод циклов, разработанный Клапейроном на основе идей Карно. До введения Гиббсом в 1870 г. метода потенциалов это был единственный метод, позволявший устанавливать связи между термодинамическими характеристиками процессов, связанных с преобразованиями, в которых участвуют теплота и работа.
Сравнивая формулы для кпд обратимого цикла Карно ηt=(T1-T2)/T1 и ηt=(Q1-Q2)/Q1 (см. формулу (3.3)), получим
![]()
По формуле (3.3) может быть найден кпд любого цикла, в том числе и цикла Карно.
Отсюда
![]() (3.8)
(3.8)
Величина Q/T, отнесенная к тому или иному телу, называется приведенной теплотой.
Из формулы (3.8) следует равенство приведенных теплот нагревателя и холодильника в цикле Карно.
Можно показать, что цикл Карно всегда можно разбить на два или больше циклов промежуточными адиабатами (рис. 3.5.) [15]. Такое деление цикла является обоснованным потому, что промежуточные адиабаты проводятся в противоположных направлениях, и оба процесса по такой адиабате взаимно компенсируются. Разобьем цикл Карно на два цикла с помощью адиабаты ab (см. рис. 3.5.). Тогда теплоты Q1 и Q2 разделяются на части
![]()
Рассмотрев каждый из образованных циклов, получим равенство приведенных теплот согласно (3.8)
![]()

Рис. 3.5 Рис. 3.6
Сложив эти равенства, находим
![]()
и вообще при разделении на несколько циклов будем иметь
![]() (3.9)
(3.9)
Допустимо также составление циклов Карно, где участвуют нагреватели и холодильники с различными температурами в разных циклах. И в этом случае составление ведется по адиабатам (рис. 3.6.). Обобщая выражение (3.9) на n циклов, получим
 (3.10)
(3.10)
Наряду с циклами, где происходит передача конечных количеств тепла Q1 и Q2, можно представить элементарные циклы, в которых передаются бесконечно малые количества тепла dQ1 и dQ2 при конечной разности температур T1 и T2. Для такого цикла
![]()
Пользуясь возможностью разбиения циклов на части любой обратимый цикл можно разбить на большое количество узких элементарных циклов Карно, соприкасающихся по адиабатам (рис. 3.7.).

Рис. 3.7
При этом отрезки адиабат, лежащие внутри контура, взаимно компенсируются. Некоторая ошибка получается вследствие замены непрерывного контура ступенчатыми изотермами сверху и снизу, а также нескомпенсированными отрезками адиабат, прилегающих к контуру. Однако при переходе к пределу, когда dQ1(i) и dQ2(i) стремятся к нулю, эта ошибка может быть сделана сколь угодно малой. Выражение (3.10) для конечного числа элементарных циклов в пределе будет иметь вид
![]() (3.11)
(3.11)
Выражение (3.11) можно переписать в виде
![]() (3.12)
(3.12)
Выражение (3.12)
можно рассматривать как алгебраическую
сумму
![]() при переменных dQ
и Т.
Так как эта сумма относится ко всему
контуру, то из (3.12) следует
при переменных dQ
и Т.
Так как эта сумма относится ко всему
контуру, то из (3.12) следует
![]() (3.13)
(3.13)
Выражение (3.13) является интегралом Клаузиуса для любого обратимого цикла. Отсюда следует, что интеграл приведенных теплот для любого обратимого цикла для всех веществ равен нулю.
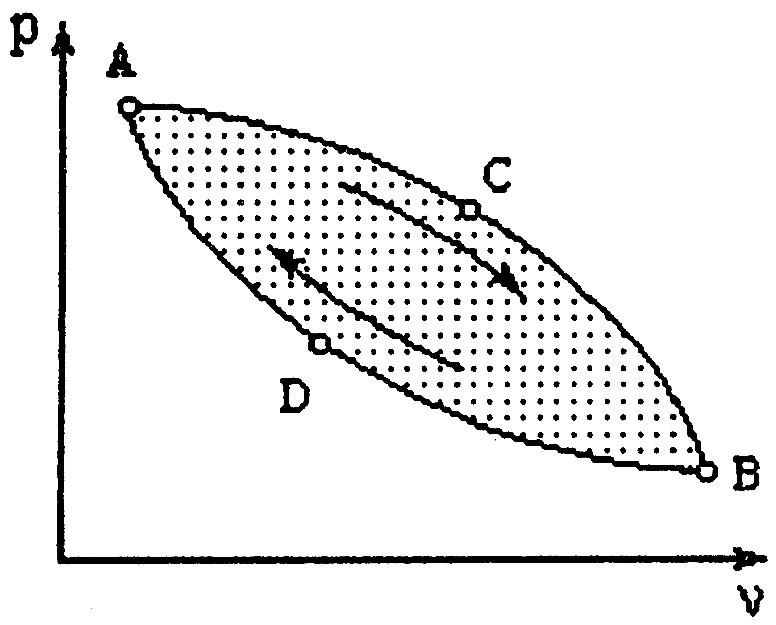
Рис. 3.8
Из соотношения
(3.13) следует, что
![]() не зависит от формы пути.
не зависит от формы пути.
Например, при изменении состояния от точки А до точки В (рис. 3.8.) по пути АСВ получим
![]()
а при движении от А к В по пути ADB будем иметь
![]()
Отсюда, следуя (3.13), можно записать
![]() или
или
![]()
Так как интеграл
по замкнутому контуру от
![]() равен нулю, а также учитывая, что изменение
этой величины не зависит от формы пути,
приходим к выводу, что бесконечно малая
величина
равен нулю, а также учитывая, что изменение
этой величины не зависит от формы пути,
приходим к выводу, что бесконечно малая
величина
![]() есть полный дифференциал некоторой
функции S
параметров состояния
есть полный дифференциал некоторой
функции S
параметров состояния
![]() (3.14)
(3.14)
Эта функция состояния называется энтропией. Интегрируя (3.14), получим общее выражение для энтропии
![]() (3.14а)
(3.14а)
где константа (const) является неопределенной постоянной интегрирования. Отсюда следует новая математическая формулировка второго начала:
величина
![]() есть полный дифференциал.
Таким образом, установлено существование
энтропии как функции состояния. Согласно
выражению (3.14) энтропия имеет следующую
единицу измерения:
есть полный дифференциал.
Таким образом, установлено существование
энтропии как функции состояния. Согласно
выражению (3.14) энтропия имеет следующую
единицу измерения:
для 1 кг массы s, Дж/(кг·К);
для любого количества вещества S, Дж/К.
Абсолютное значение энтропии может быть найдено лишь в случае, если будет известна неопределенная постоянная интегрирования.
