
1.1. Основные законы химии
Закон сохранения массы. Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции. Открыт в 1748г. М.В.Ломоносовым.
Закон сохранения и превращения энергии. Энергия не исчезает и не возникает вновь; ее различные формы могут переходить одна в другую в определенных, строго эквивалентных отношениях.
В 1905г. А.Эйнштейн показал, что между энергией и массой существует взаимосвязь, выражаемая формулой
![]() ,
(1.1)
,
(1.1)
где ΔЕ _ изменение энергии (Дж), соответствующее изменению массы Δm (кг); с – скорость света в вакууме (2,99792. 108м.с-1).
Из уравнения (1.1) следует, что любой химический процесс, сопровождающийся выделением или поглощением энергии, сопровождается соответственно уменьшением или увеличением массы. Тепловой эффект в 1 кДж соответствует изменению массы на 1,1.10-14кг. Величина тепловых эффектов химических реакций редко превышает 103 кДж/моль. По этой причине изменением массы веществ в ходе химических реакций обычно пренебрегают как незначительным.
Пример 1.1. Реакция между 2 моль водорода и 1 моль кислорода сопровождается выделением 284 кДж теплоты. Рассчитать абсолютное и относительное (%) изменение массы реагирующих веществ в ходе реакции.
Решение. Из уравнения (1.1) следует, что абсолютное уменьшение массы реагирующих веществ
![]()
![]() Из
условия задачи вытекает, что исходная
масса реагирующих веществ
Из
условия задачи вытекает, что исходная
масса реагирующих веществ
![]()
Следовательно, относительное уменьшение массы
![]() .
.
Закон постоянства состава. Любое химически чистое соединение имеет постоянный состав и свойства независимо от способа и места его получения. Закон был сформулирован французским химиком Ж.Прустом в начале XIX века. Позднее было установлено, что все химические вещества делятся на соединения постоянного состава (дальтониды) и соединения переменного состава (бертоллиды). К дальтонидам принадлежат большинство кислот, оснований, солей. К бертоллидам относятся многие двойные соединения, особенно соединения d-элементов. Например, в зависимости от способа получения моносульфид железа существует в интервале составов FeS0,8-1,14. Закон постоянства состава применим только к соединениям постоянного состава.
Закон эквивалентов. Закон открыт И.Рихтером в период 1792-1802 гг. Вещества реагируют между собой в отношениях, пропорциональных молярным массам их эквивалентов.
В законе используется понятие эквивалент _ это условные или реальные частицы вещества, в zB раз меньшие, чем соответствующие им формульные единицы.
Формульная
единица вещества _ это реально
существующие частицы, таки, как атомы
(Н, С, О), молекулы ( N2,
Н2О, H2SO4),
ионы
![]() или условно существующие частицы (NaCl,
К2SO4) и т.д.
или условно существующие частицы (NaCl,
К2SO4) и т.д.
Число
zB
называют числом эквивалентности
или эквивалентным числом,
![]() Значение zB
определяют по химической реакции, в
которой участвует данное вещество, или
по формуле вещества. В зависимости от
природы вещества и реакции, в которой
это вещество участвует, число
эквивалентности может изменяться.
Значение zB
определяют по химической реакции, в
которой участвует данное вещество, или
по формуле вещества. В зависимости от
природы вещества и реакции, в которой
это вещество участвует, число
эквивалентности может изменяться.
Величина, обратная числу эквивалентности, называется фактором эквивалентности fB=1/zB.
Пример 1.2. Определить число эквивалентности: 1) серной кислоты в реакциях
1а) H2SO4 + 2NaOH = Na2SO4 + 2H2O
1в) H2SO4 + NaOH = NaHSO4 + H2O
2) фосфора в реакциях
2а) 4Р + 3О2 =2Р2О3
2в) 4Р + 5О2 =2Р2О5
Решение.
1) В обменной реакции нейтрализации (1а)
1 формульная единица (ФЕ) серной кислоты
реагирует с 2 ФЕ гидроксида натрия,
следовательно, число эквивалентности
серной кислоты
![]()
В
реакции (1в) 1 ФЕ серной кислоты реагирует
с 1 ФЕ гидроксида натрия, следовательно,
число эквивалентности серной кислоты
![]()
-
Взаимодействие фосфора с кислородом относится к окислительно-восстановительным реакциям. В этом случае число эквивалентности равно числу электронов, принимаемых 1ФЕ окислителя, или числу электронов, отдаваемых 1ФЕ восстановителя. В реакции (2а) фосфор выступает в роли восстановителя и имеет место процесс
Р –3е = Р3+
Следовательно, число эквивалентности фосфора zР=3.
В реакции (2а) имеем
Р –5е = Р5+
и zР=5.
Число эквивалентности может быть формально определено по формуле вещества. Для простого вещества число эквивалентности равно абсолютной величине степени окисления, проявляемой одним атомом; для бинарных соединений – абсолютной величине суммы положительных или отрицательных степеней окисления атомов, составляющих соединение; для оснований, кислот и солей _ абсолютной величине суммы положительных или отрицательных зарядов ионов, образующих соединение.
Пример 1.3. Определить числа эквивалентности: 1) кислорода; 2) азота; 3) оксида азота (IV); 4) гидроксида кальция; 5) серной кислоты; 6) сульфата алюминия.
Решение.
1) Кислород проявляет степень окисления
(-2), следовательно, число эквивалентности
атомарного кислорода (О) zO=2,
а число эквивалентности молекулярного
кислорода (О2 )
![]()
2) Азот может иметь степени окисления (-3, -2, 0, +1, +2, +3, +4, +5). Следовательно, атомарный азот (N) может иметь числа эквивалентности 1, 2, 3, 4, 5, а молекулярный азот (N2), соответственно, 2, 4, 6, 8, 10.
3) Формула
оксида азота (IV) – NO2.
Степень окисления азота составляет
(+4), а атома кислорода _ (-2). Абсолютная
величина суммы положительных или
отрицательных степеней окисления
составляет число эквивалентности
![]()
4)Гидроксид кальция Са(ОН)2 диссоциирует по уравнению
![]()
Абсолютная
величина суммы зарядов положительного
иона кальция (катиона) или двух
отрицательных ионов гидроксида (анионов)
равна 2. Следовательно,
![]()
5)Серная кислота диссоциирует по уравнению
![]()
Абсолютная
величина суммы зарядов двух положительных
ионов водорода или отрицательного
иона (сульфат-иона) равна 2. Следовательно,
![]()
-
Сульфат алюминия Al2(SO4)3 диссоциирует по уравнению
![]()
Абсолютная
величина суммы зарядов двух положительных
ионов алюминия или трех отрицательных
ионов (сульфат-ионов) равна 6. Следовательно,
![]()
Подчеркнем, что определение числа эквивалентности по формуле носит формальный характер, т.к. не связано с конкретной химической реакцией.
Применение закона эквивалентов требует введения понятия количества вещества эквивалентов В (символ nэк(В), единица _ моль) _ физическая величина, пропорциональная числу эквивалентов вещества В, Nэк(В):
![]() (1.2)
(1.2)
где NA _ постоянная Авогадро.
Например: nэк(3;Н3РO4)= 1,5 моль, nэк(2;Са2+)= 2 ммоль. Цифры 3 и 2 _ значения чисел эквивалентности.
Так как в одной формульной единице вещества В содержится zB эквивалентов этого вещества, то справедливо соотношение
nэк(В)=zВnB , (1.3)
где nB _ количество вещества В, моль.
В расчетах на основе закона эквивалентов используется также понятие молярной массы эквивалентов вещества В (символ Мэк(В), единица _ кг/моль или г/моль) _ это отношение массы вещества В (mB) к количеству вещества эквивалентов В (nэк(В)):
![]() (1.4)
(1.4)
Молярная масса эквивалентов вещества В всегда в zB раз меньше молярной массы этого же вещества. Поэтому для вычислений можно использовать также следующую формулу:
![]() (1.5)
(1.5)
Для газообразных веществ используют также понятие молярного объема эквивалентов вещества В (символ Vэк(В), единица _ л/моль или дм3/моль). Эта величина может быть найдена как отношение молярного объема вещества В (VB) к числу эквивалентности вещества В (zэк(В)):
![]() (1.6)
(1.6)
Пример 1.4. Определить молярную массу эквивалентов следующих веществ: 1)Cr2O3; 2) фосфора в соединении РН3; 3) соли NaH2PO4 в реакции NaH2PO4 + 2NaOH = Na3PO4 + 2 H2O.
Решение. 1) Степень окисления атома кислорода в оксиде Cr2O3 составляет (-2). Абсолютная величина суммы степеней окисления трех атомов кислорода - 6. Следовательно, число эквивалентности оксида равно 6. Молярная масса Cr2O3
![]() г/моль.
г/моль.
Таким образом, молярная масса эквивалентов Cr2O3
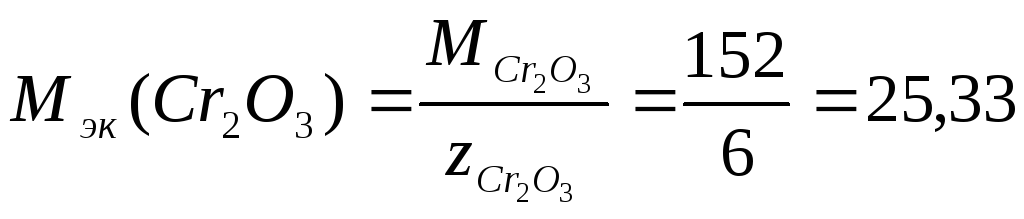 г/моль.
г/моль.
2) Степень окисления атома водорода в гидриде фосфора (фосфин) РН3 составляет (+1). Абсолютная величина суммы степеней окисления трех атомов водорода составляет 3. Следовательно, степень окисления фосфора равна (-3) и число эквивалентности фосфора равно 3. Молярная масса фосфора составляет 31 г/моль, а молярная масса эквивалентов фосфора в фосфине
![]() г/моль.
г/моль.
3) Одна формульная единица дигидрофосфата натрия (NaH2PO4) реагирует с двумя формульными единицами гидроксида натрия. Число эквивалентности гидроксида натрия равно 1, следовательно, число эквивалентности NaH2PO4 в данной реакции составляет 2. Таким образом, молярная масса эквивалентов NaH2PO4 будет
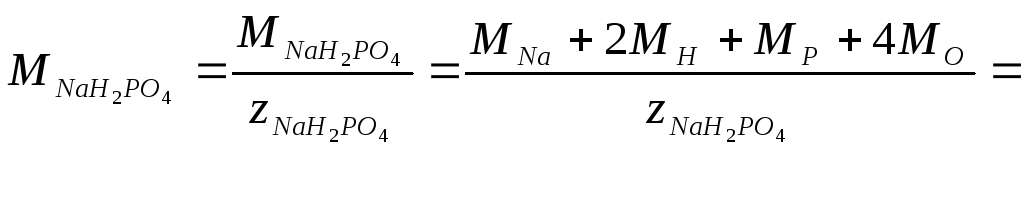
=(23+2.1+31+4.16)/2=60 г/моль.
Пример 1. 5. Сульфид металла содержит 67,15 % металла. Вычислить молярную массу эквивалентов металла, если молярная масса эквивалентов серы составляет 16 г/моль.
Решение. Из условия задачи следует, что 100 г сульфида металла содержит 67,15 г металла и 32,85 г серы. Согласно закону эквивалентов эти массы пропорциональны молярным массам эквивалентов металла и серы. Следовательно,
