
- •Вводный курс
- •1. Основные понятия
- •1.1. Атом, молекула. Элемент, простое вещество,
- •1.2. Моль. Молярная масса. Закон Авогадро.
- •1 Моль газа занимает объем 22,4л
- •1 Моль серной кислоты содержит 6,02.1023 формульных единиц h2so4
- •1.3. Химические формулы
- •1.4. Химические уравнения
- •Контрольные вопросы и задачи
- •2. Периодическая система элементов д.И.Менделеева
- •2.1. Строение атома
- •2.2. Периодическая система
- •Контрольные вопросы и задачи
- •3. Основные классы неорганических веществ
- •3.1. Металлы. Неметаллы.
- •3.2. Бинарные соединения (оксиды, галогениды, сульфиды)
- •3.3. Гидроксиды (кислоты, основания, амфотерные гидроксиды)
- •3.4. Соли
- •3.5.Электролитическая диссоциация гидроксидов и солей
- •Контрольные вопросы и задачи
- •4. Окислительно-восстановительные процессы
- •4.1. Основные понятия
- •4.2. Уравнивание окислительно-восстановительных реакций
- •Контрольные вопросы и задачи
- •5. Способы выражения концентраций растворов
- •5.1. Массовая доля
- •100Г раствора содержат 5г CuSo4
- •160Г CuSo4 содержатся в 250г CuSo4.5н2о
- •100Г 98 % раствора содержат 98г н2so4
- •Основной курс
- •1. Введение
3.3. Гидроксиды (кислоты, основания, амфотерные гидроксиды)
Основания и содержащие кислород кислоты имеют в своём составе гидроксидную группу (ОН), и называются гидроксидами. Например:
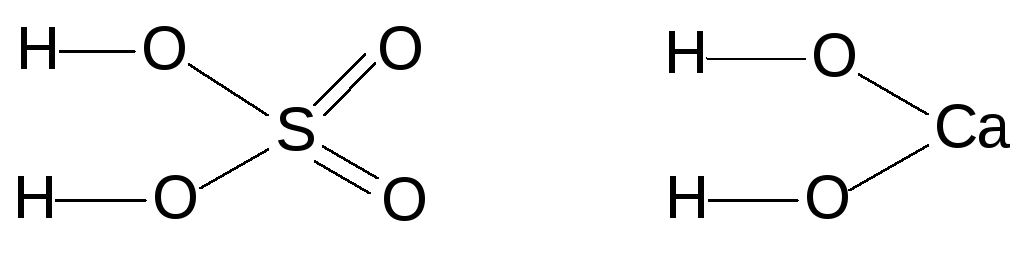
Различия в химических свойствах гидроксидов определяются различиями свойств атомов, с которыми связаны гидроксидные группировки ОН. Гидроксиды, образованные атомами с валентностью, равной 1,почти всегда являются основаниями. Большинство гидроксидов, образованных двухвалентными атомами, также относятся к основаниям. Гидроксиды, образованные атомами с валентностью от 4 до 8, относятся к кислотам. Если же валентность атомов равна 3, то их гидроксиды обычно являются амфотерными. Амфотерными являются также некоторые из гидроксидов двухвалентных и четырехвалентных атомов.
Для кислот характерны следующие основные химические свойства:
1) взаимодействие с активными металлами с образованием солей и выделением водорода:
H2SO4 + Mg = MgSO4 + H2;
2) взаимодействие с основаниями и амфотерными гидроксидами (реакция нейтрализации), в результате чего образуются соли и вода:
HNO3 + NaOH = NaNO3 + H2O;
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O;
3) взаимодействие с основными и амфотерными оксидами с образованием солей и воды:
2HCl + MgO = MgCl2 + H2O;
2HCl + ZnO = ZnCl2 + H2O.
Наиболее типичными реакциями оснований являются:
1) взаимодействие с кислотами и амфотерными гидроксидами с образованием солей и воды (реакция нейтрализации):
Са(OH)2 + H2SO4 = СаSO4 + H2O;
Са(OH)2 + Zn(OH)2 = СаZnO2 + 2H2O;
2) взаимодействие с кислотными и амфотерными оксидами с образованием солей и воды:
2KOH + CO2 = K2CO3 + H2O;
2NaOH + Al2O3 = 2NaAlO2 + H2O.
Амфотерные гидроксиды ведут себя в реакциях с кислотами как основания, а в реакциях с основаниями как кислоты.
В таблице 3.1. приведены формулы и названия важнейших кислот и их солей и ряда оснований.
3.4. Соли
Соединения, содержащие в своём составе атомы металлов и кислотные остатки, называются солями.
Соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металла. При полном замещении всех атомов водорода в молекуле кислоты образуются средние соли, например Na2SO4 – сульфат натрия. При частичном замещении атомов водорода образуются кислые соли, например NaHSO4 – гидросульфат натрия (устаревшее название – бисульфат натрия).
Соли можно также рассматривать как продукты замещения гидроксидных групп в молекуле основания на кислотные остатки. При полном замещении всех гидроксидных групп образуются средние соли, например СаCl2. При частичном замещении образуются основные соли, например Ca(OH)Cl – гидроксохлорид кальция. Очевидно, что
Таблица 3.1. Формулы и названия некоторых оснований, кислот и их солей.
|
Формула |
Химическое название |
Синоним (тривиальное название) |
Химическое название солей |
|
H2SO4 |
Серная кислота |
|
Сульфаты |
|
HNO3 |
Азотная кислота |
|
Нитраты |
|
HCl |
Хлористоводородная кислота |
Соляная кислота |
Хлориды |
|
H2CO3 |
Угольная кислота |
|
Карбонаты |
|
NaOH |
Гидроксид натрия |
Едкий натр, каустическая сода |
|
|
KOH |
Гидроксид калия |
Едкое кали |
|
|
Ca(OH)2 |
Гидроксид кальция |
Гашеная известь |
|
|
NH4OH |
Гидроксид аммония |
Водный ам-миак, наша-тырный спирт |
|
основные соли не могут быть образованы гидроксидами одновалентных металлов.
Приведем некоторые химические свойства солей:
1) взаимодействие с растворимыми в воде основаниями (NaOH, КOH, Са(OH)2); реакции протекают в том случае, если образующийся гидроксид плохо растворим в воде.:
Zn(NO3)2 + 2NaOH =2 NaNO3 + Zn(OH)2 ↓.
Стрелка означает, что гидроксид цинка выпадает в осадок.
2) взаимодействие с кислотами; реакция протекает, если продукт реакции является летучим:
Na2CO3 + H2SO4 = Na2SO4 + H2CO3;
Угольная кислота неустойчива, легко разлагается на воду и летучий углекислый газ. Иначе реакция может быть записана так:
Na2CO3 + H2SO4 = Na2SO4 + H2О + CO2↑.
Стрелка означает, что углекислый газ улетучивается.
3) Соли взаимодействуют друг с другом, если один из продуктов реакции плохо растворим в воде:
Na2CO3 + СаCl2 = СаCO3↓ + 2NaCl.
