
- •Предисловие
- •Лабораторная работа № 1 Определение термического коэффициента давления газа
- •Теоретическая часть
- •Экспериментальная часть Описание установки
- •Выполнение работы
- •Определение универсальной газовой постоянной методом откачки
- •Экспериментальная часть Описание установки
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № 3 Определение отношения теплоемкостей для воздуха методом Клемана-Дезорма
- •Теоретическая часть
- •1 Состояние: , , ;
- •2 Состояние: , т, ;
- •3 Состояние: , , .
- •Экспериментальная часть Описание установки
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № 4 Определение коэффициента вязкости воздуха
- •Теоретическая часть
- •Экспериментальная часть Описание установки
- •Выполнение работы
- •Определение удельной теплоты перехода воды в пар при температуре кипения
- •Экспериментальная часть Описание установки и метод измерения
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Лабораторная работа № 6 Определение коэффициента внутреннего трения жидкости
- •Теоретическая часть
- •1. Метод Стокса
- •Экспериментальная часть Описание установки и метод измерения
- •Выполнение работы
- •2. Метод сравнения Теоретическая часть
- •Экспериментальная часть Описание установки и метод измерения
- •Выполнение работы
- •Контрольные вопросы:
- •Литература
- •Лабораторная работа № 7 Определение коэффициента поверхностного натяжения жидкости
- •Теоретическая часть
- •1. Метод отрыва кольца
- •Экспериментальная часть Описание установки и метод измерения
- •Выполнение работы
- •2. Метод отрыва капель
- •Описание установки и метод измерения
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Математическая обработка результатов эксперимента Прямые измерения1
- •Косвенные измерения1
- •Запись результатов вычислений
- •Литература
- •Предельные погрешности приборов, используемых в лабораторных работах
- •Погрешности разновесов
- •Погрешности табличных значений
Контрольные вопросы
-
Что такое теплоемкость?
-
Как связаны между собой величины
 и
и
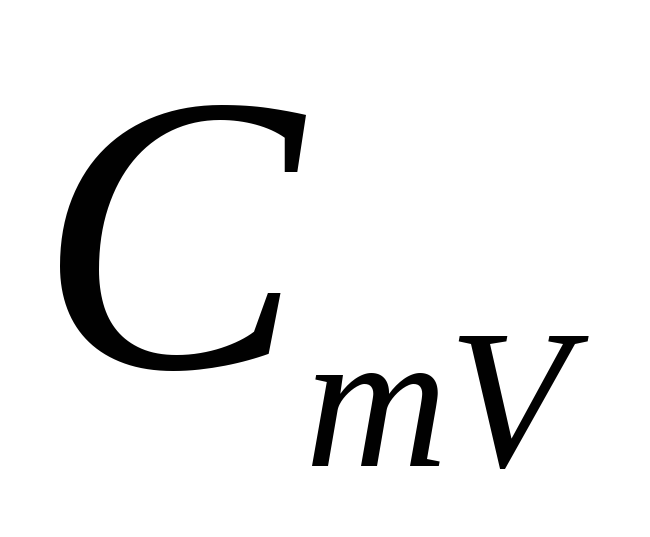 ?
Какая из этих величин больше и почему?
?
Какая из этих величин больше и почему? -
В чем заключается метод Клемана-Дезорма? Получите расчетную формулу.
-
Почему при резком открывании крана (5) на короткое время считаем, что газ расширяется адиабатически?
-
Чему равно изменение внутренней энергии газа для любого процесса?
-
Как вычислить молярные теплоемкости и величину
 через число степеней свободы i
молекулы газа?
через число степеней свободы i
молекулы газа?
Литература
-
Сивухин Д.В. Общий курс физики. Термодинамика и молекулярная физика. М.: Наука, 1979.
-
Савельев И.В. Курс общей физики, Т. 1. М.: 1977.
-
Кикоин И.К., Кикоин А. К. Молекулярная физика. М.: 1963.
-
Физические величины: Справочник / Под ред. И. К. Кикоина.- М.: Атомиздат, 1976.
Лабораторная работа № 4 Определение коэффициента вязкости воздуха
Цель работы: вычисление средней длины свободного пробега и эффективного диаметра молекулы азота, который составляет 78,1% воздуха, по коэффициенту внутреннего трения воздуха.
Теоретическая часть
Заметное отклонение молекул от прямолинейных траекторий при тепловом движении происходит только при их достаточном сближении. Такое взаимодействие между молекулами называется столкновением. Процесс столкновения удобно характеризовать величиной эффективного диаметра молекулы. Под ним понимают минимальное расстояние, на которое могут сблизиться центры двух молекул при их столкновении.
Расстояние, которое
проходит молекула между двумя
последовательными столкновениями,
называют длиной
свободного пробега
молекулы. Из-за хаотичности движения
молекул длина свободного пробега
изменяется от столкновения к столкновению,
поэтому на практике важно знать среднюю
длину свободного пробега молекул
![]() .
.
Молекулярно-кинетическая теория позволила получить формулы, в которых макроскопические параметры газа связаны с его микропараметрами. Пользуясь этими формулами, можно при помощи легко измеримых макропараметров (давление, температура, коэффициент внутреннего трения) получить интересующие нас микропараметры (размер молекулы, среднюю длину ее свободного пробега).
Молекулярно-кинетическая
теория устанавливает связь между средней
длиной свободного пробега
![]() ,
эффективным диаметром молекул d
и концентрацией молекул в газе n:
,
эффективным диаметром молекул d
и концентрацией молекул в газе n:
![]() .
(1)
.
(1)
Внутреннее трение
(вязкость) газа характеризуется
коэффициентом вязкости
![]() ,
который зависит от плотности газа
,
который зависит от плотности газа
![]() ,
средней скорости молекул
,
средней скорости молекул
![]() и средней длины свободного пробега
и средней длины свободного пробега
![]() следующим образом:
следующим образом:
![]() .
(2)
.
(2)
Средняя скорость молекул идеального газа может быть вычислена из закона распределения Максвелла:
![]() (3)
(3)
где R- универсальная газовая постоянная, T- температура, M- молярная масса газа.
Плотность газа
(![]() )
можно определить, используя уравнение
Менделеева-Клапейрона:
)
можно определить, используя уравнение
Менделеева-Клапейрона:
![]() ,
(4)
,
(4)
где p- давление газа. Из формул (2), (3) и (4) получим:
![]() .
(5)
.
(5)
Если в эксперименте
измерить коэффициент вязкости воздуха
![]() ,
то по формуле (5) легко вычислить среднюю
длину свободного пробега молекул
,
то по формуле (5) легко вычислить среднюю
длину свободного пробега молекул
![]() ,
а затем при помощи формулы (1) вычислить
эффективный диаметр молекулы
,
а затем при помощи формулы (1) вычислить
эффективный диаметр молекулы
![]() ,
предварительно выразив концентрацию
из формулы:
,
предварительно выразив концентрацию
из формулы:
![]() ,
(6)
,
(6)
где
![]() -
постоянная Больцмана (
-
постоянная Больцмана (![]() ).
).
Из формул (1), (5) и (6) получим:
![]() .
(7)
.
(7)
При ламинарном
протекании газа (или жидкости) через
цилиндрическую трубку длиной
![]() и диаметром
и диаметром
![]() объем газа V,
протекающего за время
объем газа V,
протекающего за время
![]() ,
зависит от вязкости. Эта зависимость
выражается формулой Пуазейля1:
,
зависит от вязкости. Эта зависимость
выражается формулой Пуазейля1:
![]() ,
(8)
,
(8)
где
![]() -
разность давлений на концах трубки. В
данной работе измеряются V,
-
разность давлений на концах трубки. В
данной работе измеряются V,
![]() ,
τ
и из формулы (8) определяется
,
τ
и из формулы (8) определяется
![]() .
.
