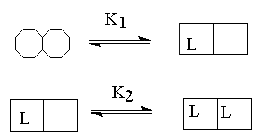- •Строение белка. Уровни структурной организации молекулы белка.
- •Строение, размер и форма белковой молекулы, функции белков.
- •Денатурация, причины и признаки, использование в медицине.
- •Ферменты. Особенности ферментативного катализа. Строение и структура ферментов.
- •Полиферментные комплексы, метаболоны.
- •Механизм действия ферментов. Этапы ферментативного катализа.
- •Факторы, определяющие активность ферментов [e], [s], [p], Km. Влияние pH, [p], tº, ионной силы на активность ферментов.
- •Изостерическая и аллостерическая регуляция.
- •Николаев а. Я. Биологическая химия. М.: Высшая школа, 1989. С. 52–92.
- •Марри р. И др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 63–75.
- •Филиппович ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 105–144.
- •1. Мультимедийная презентация.
- •Механизмы и роль аллостерической регуляции. Характеристика аллостерических ферментов. Виды ингибирования (обратимое, необратимое, конкурентное, неконкурентное, бесконкурентное).
- •Изоферменты, их природа, биологическая роль, строение лдг.
- •Изменение активности ферментов в онтогенезе.
- •Николаев а. Я. Биологическая химия. М.: Высшая школа, 1989. С. 52–92.
- •Марри р. И др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 63–75.
- •Филиппович ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 105–144.
- •1. Мультимедийная презентация.
- •Локализация ферментов в клетке, органоспецифические и маркерные ферменты.
- •Качественное обнаружение и количественное определение активности. Единицы активности (мe, катал). Удельная активность. Число оборотов ферментов.
- •Сопряженные ферментные системы их применение. Номенклатура, классификация ферментов (тривиальная, рациональная, систематическая). Принципы классификации.
- •Медицинская энзимология. Основные направления Применение ферментов в лабораторной диагностике, производственной практике и биотехнологии.
- •Энзимопатии. Патогенез энзимопатий. Энзимодиагностика, цель, задачи. Типы ферментов плазмы крови.
- •Энзимотерапия. Примеры. Иммобилизованные ферменты, липосомы, тени эритроцитов, вирусные векторы. Биотехнология.
- •История развития учения о биологическом окислении
- •Современные представления о бо. Основные этапы бо. Строение атф, природа макроэргичности.
- •Митохондрия. Строение, функции, сравнительная характеристика мембран митохондрий. Характеристика ферментов мембран, межмембранного пространства, мx матрикса.
- •Цтк, история открытия, реакции, ферменты, коферменты, субстраты. Биологическая роль, регуляция цтк. Метаболоны цтк.
- •1. Энергетическая функция.
- •2. Пластическая функция.
- •3. Регуляторная.
- •Строение дыхательной цепи (дц), комплексы, ингибиторы. Механизм работы. Пункты сопряжения, величина овп компонентов дц. Коэффициент р/о, его значение.
- •Свободное и разобщенное дыхание. Теории сопряжения оф.
- •Структура и функция протонной атф-азы. Механизм разобщения.
- •Оф (снятие pH и ). Механизмы термогенеза. Роль бурой жировой ткани.
- •Пути потребления o2 в организме. Характеристика микросомальной дц, ее сравнение с митохондриальной. Характеристика цитохромов p450, их функция.
- •1. Сходства: а) они имеют одинаковые начало и конец и одинаковую суммарную разность потенциалов (а значит одинаковый градиент энергии в начале и конце);
- •2. Различия: а) по локализации;
- •Антиоксидантная защита: ферментная и неферментная.
- •1. Мультимедийная презентация.
- •1. Мультимедийная презентация.
-
Березов Т. Т., Коровкин Б. Ф. Биологическая химия. М.: Медицина, 1990. С. 126–132; 1998. С. 157–168.
-
Николаев а. Я. Биологическая химия. М.: Высшая школа, 1989. С. 52–92.
Дополнительная
-
Марри р. И др. Биохимия человека. М.: Мир, 1993. Т. 1. С. 63–75.
-
Филиппович ю. Б. Основы биохимии. М.: Высшая школа, 1993. С. 105–144.
-
Врожденные и приобретенные энзимопатии / Под ред. Ташева Т. М.: Медицина, 1980.
-
Вилкинсон Д. Принципы и методы диагностической энзимологии. М.: Медицина, 1981.
-
Руководство по клинической лабораторной диагностике. Киев: Вища школа, 1990. С. 167–186.
-
Зилва Ф., Пеннел Дж. Клиническая химия в диагностике и лечении. М.: Медицина, 1986. С. 372–388.
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ
1. Мультимедийная презентация.
РАСЧЕТ УЧЕБНОГО ВРЕМЕНИ
|
№ п/п |
Перечень учебных вопросов |
Количество выделяемого времени в минутах |
|
|
Механизмы и роль аллостерической регуляции. Характеристика аллостерических ферментов. Виды ингибирования (обратимое, необратимое, конкурентное, неконкурентное, бесконкурентное). |
30 |
|
|
Регуляция активности ферментов путем химической модификации: Реакции ограниченного протеолиза, аденилирования, рибозилирования, ацетилирования, фосфорилирования (роль гормонов, АЦ-комплекса, цАМФ, цГМФ, ионов Ca). |
30 |
|
|
Изоферменты, их природа, биологическая роль, строение ЛДГ. |
20 |
|
|
Изменение активности ферментов в онтогенезе. |
10 |
Всего 90 мин
-
Механизмы и роль аллостерической регуляции. Характеристика аллостерических ферментов. Виды ингибирования (обратимое, необратимое, конкурентное, неконкурентное, бесконкурентное).
Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
При знакомстве с материалом по кинетике ферментов могло сложиться впечатление, что кинетика всех ферментов основана на принципах Михаэлиса и Ментен. Исключением было только влияние избытка субстрата. У ферментов, подчиняющимся принципам кинетики Михаэлиса и Ментен с позиций процессов, протекающих в клетке, имеется ряд недостатков. Для обеспечения нормальной жизнеспособности клетки требуется тонкая регуляция концентрации большинства метаболитов. Существует довольно узкий диапазон допустимых концентраций субстратов в клетке при потребности быстро реагировать изменениями скоростей реакции в широких пределах в ответ на постоянно меняющееся функциональное состояние клетки. Приведенный ранее расчет показывает, что скорости реакций мало чувствительны к изменениям концентрации субстрата. Например, повышение скорости от 0,1 Vmax до 0.9 Vmax требует повышения концентрации субстрата в 81 раз. Такие же цифры характеризуют и действие ингибиторов. Ферменты, управляющие превращениями метаболитов должны быть более чувствительны к изменению концентраций и субстрата и ингибитора. Таким образом, природа вынуждена обратиться к "кооперативным" системам, в которых маленькие изменения в одном параметре, например концентрации ингибитора, вызывают большие изменения в скорости. Графически результат работы такой кооперативной системы (график зависимости скорости реакции от концентрации субстрата) выражается не гиперболой, а S-образной сигмоидной кривой (сигмоидальные кривые всегда сдвинуты вправо в сравнении с гиперболой). Существует большое семейство ферментов, которые представляют такие кооперативные системы. Это аллостерические ферменты.
Определение. Аллостерический белок определяется как белок, содержащий два или больше топологически различающихся центра связывания лигандов (субстраты, ингибиторы и т.д), которые функционально взаимодействуют друг с другом. Связывание лиганда, с одним центром изменяет свойства другого (их).
Большая часть аллостерических белков – аллостерические ферменты, но некоторые белки, типа гемоглобина, выполняют и другие функции.
Кооперативность Кооперативность - модификация константы связывания лиганда белком предшествующим связыванием другого лиганда. Константы связывания - подобны Ks для субстрата или Ki для ингибитора, являются в основном константами диссоциации белка и лиганда и указывает силу связывания, или сродство белка и лиганда. Км обычно принимается как константа связывания субстрата, поскольку ее проще измерять, чем Ks. Понятие кооперативность означает, что связывание одного лиганда к белку или увеличит или уменьшит способность белка, связывать вторую молекулу лиганда. Если модификация увеличивает способность связывания (или сродство), это называют положительной кооперативностью. Если способность связывания снижается - это отрицательная кооперативность. Два лиганда один из которых влияет на связывание другого, могут быть химически идентичны, например, одна молекула субстрата, изменяет связывание другой молекулы субстрата. Такое взаимодействие называют гомотропным эффектом. Если они химически различаются, например, влияние ингибитора на связывание субстрата, тогда это - гетеротропный эффект.
У аллостерических ферментов особые свойства
Аллостерические ферменты обладают рядом свойств, которые отличают их от не аллостерических. Следует подчеркнуть, что приведенные ниже свойства не обязательны для всех аллостерических белков. Это – общие особенности, по крайней мере некоторые из них проявляются у отдельных аллостерических белков.
-
Полимерная структура
-
Сигмоидная ( в отличие от гиперболической для не аллостерических) форма кривой зависимости скорости реакции от концентрация субстрата
-
Существование эффекторов
-
Двухфазный ответ на конкурентные ингибиторы
-
Потеря аллостерических свойств при денатурации
Полимерная структура. Все аллостерические ферменты и белки имеют полимерную или четверичную структуру. Это значит, что типичный аллостерический белок будет состоять из ряда отдельных белковых цепей или субъединиц, которые связаны друг с другом слабыми взаимодействиями типа водородных связей и гидрофобного взаимодействия. Полимерная структура – ключевое свойство для функции аллостерического белка.
|
|
|
|
Кооперативное связывание |
Не кооперативное связывание |
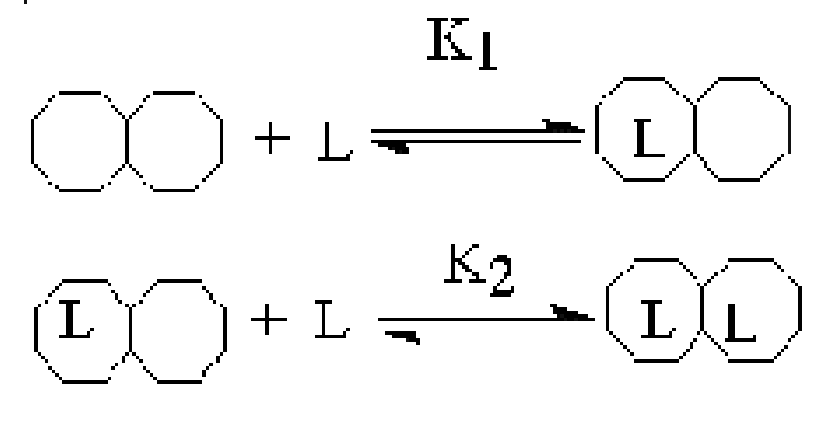
Аллостерический фермент содержит ряд активных центров, в самом простом случае по одному на субъединицу, каждый из которых может связываться с лигандом. Взаимодействие между этими центрами и является основой кооперативности. Так, в типичном аллостерическом ферменте связывание молекулы лиганда к одному из активных центров инициирует изменение конформации, которое увеличит способность других активных центров связывать лиганды (положительная кооперативность. K2 << K1) или понизит их сродство к лиганду (отрицательная кооперативность K1 << K2). При отсутствии кооперативного взаимодействия -K1 = K2.
Субъединицы
связаны друг с другом слабым
взаимодействием, поэтому аллостерический
фермент будет часто существовать в
растворе в равновесии между целым
ферментом и индивидуальными субъединицами.
При большом числе субъединиц могут
возникать промежуточные формы между
этими крайними формами, в которых будут
связаны несколько субъединиц, но в
меньшем количестве, чем в целом
ферменте. В этом случае одиночная
субъединица не может быть каталитически
активна. Самая маленькая каталитически
активная структура названа протомером.
Связывание лигандов (субстрат, продукт
или эффектор) к ферменту изменяет
позицию равновесия между субъединицами.
Сигмоидная кинетика. При
составлении графика зависимости
скорости от концентрации субстрата
для ферментативной реакции для
аллостерических ферментов получается
несколько иной тип кривой, называемой
сигм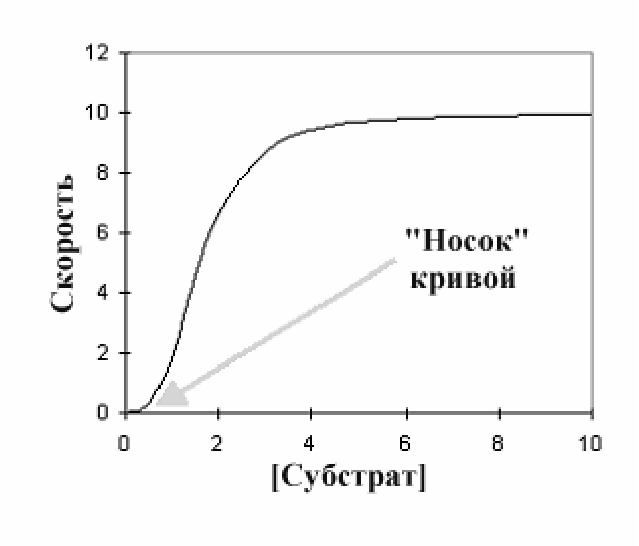 оидальной
в отличие от гиперболической для не
аллостерических ферментов. Ключевой
элемент этой кривой, который отличает
ее от гиперболической - «носок» у
основания кривой , который можно видеть
при низких концентрациях субстрата.
В этой точке увеличение концентрации
субстрата вызывает очень незначительное
увеличение в скорости - диаграмма имеет
очень небольшой наклон. При более
высоких уровнях субстрата, (выше 0.5
единиц концентрации на этом графике)
можно видеть, что увеличение концентрации
субстрата начинает вызывать намного
более значительное увеличение в
скорости, и кривая становится более
крутой. При высоких концентрациях
субстрата график становится очень
похожим на гиперболический график, и
можно видеть такую же пологую кривую
как и на графике уравнения Михаэлиса
и Ментен.
оидальной
в отличие от гиперболической для не
аллостерических ферментов. Ключевой
элемент этой кривой, который отличает
ее от гиперболической - «носок» у
основания кривой , который можно видеть
при низких концентрациях субстрата.
В этой точке увеличение концентрации
субстрата вызывает очень незначительное
увеличение в скорости - диаграмма имеет
очень небольшой наклон. При более
высоких уровнях субстрата, (выше 0.5
единиц концентрации на этом графике)
можно видеть, что увеличение концентрации
субстрата начинает вызывать намного
более значительное увеличение в
скорости, и кривая становится более
крутой. При высоких концентрациях
субстрата график становится очень
похожим на гиперболический график, и
можно видеть такую же пологую кривую
как и на графике уравнения Михаэлиса
и Ментен.
Такой тип диаграммы характерен для положительной субстратной кооперативности. При очень низких концентрациях субстрата лишь небольшое количество активных центров фермента связываются с субстратом и фермент будет иметь низкое сродство к субстрату. Поэтому добавление большего количества субстрата вызывает только небольшое увеличение в скорости реакции, поскольку субстраты связываются очень плохо. Однако, по мере повышения числа связавшихся молекул субстрата, положительный кооперативный эффект увеличивает способность фермента связывать субстраты, и кривая на графике начинает это показывать, круто перемещаясь вверх. В конечном счете, точно так же как и в случае классической гиперболической кривой, ферменты постепенно насыщаются субстратом и линия делается пологой, показывая достижение максимальной скорости. Такой тип кривой не обязателен для всех аллостерических ферментов. В частности, многие ферменты катализируют превращение нескольких субстратов и исследования показывают, что такие ферменты могут проявлять положительную кооперативность (сигмоидальная кривая) для одного субстрата и катализировать реакцию по гиперболической кривой для другого.
Эффектор. Аллостерические ингибиторы и активаторы объединяют общим названием эффекторы. Эффектор - одна из важных особенностей аллостерических ферментов. Возможность изменять скорость реакции, катализируемой ферментом, ингибиторами и активаторами - краеугольный камень принципов регуляции метаболизма. Следующий график показывает пути, по которым эффекторы изменяют кинетический график типичного аллостерического фермента с положительной субстратной кооперативностью.
Ц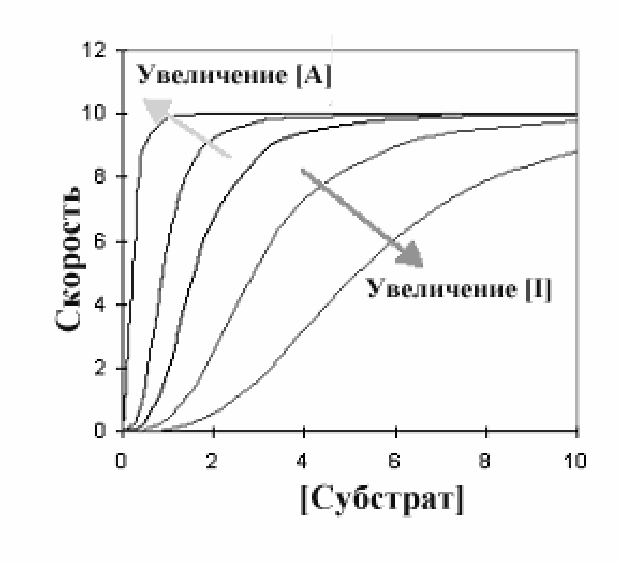 ентральная
линия графика - типичная сигмовидная
кривая в отсутствии любого эффектора.
В присутствии активатора (А) скорость
реакции повышается при любой данной
концентрации субстрата, в то время как
ингибитор уменьшает скорость реакции.
Интересны и изменения общей формы
кривой по сравнению с центральной
линией. Ингибитор увеличил сигмовидную
форму, удлиняя «носок» кривой, в то
время как активатор оказывал
противоположный эффект. При более
высокой концентрации активатора график
в целом приобретает характер гиперболы.
Это указывает на то, что аллостерический
ингибитор увеличивает уровень субстратной
кооперативности, в то время как активатор
уменьшает его.
ентральная
линия графика - типичная сигмовидная
кривая в отсутствии любого эффектора.
В присутствии активатора (А) скорость
реакции повышается при любой данной
концентрации субстрата, в то время как
ингибитор уменьшает скорость реакции.
Интересны и изменения общей формы
кривой по сравнению с центральной
линией. Ингибитор увеличил сигмовидную
форму, удлиняя «носок» кривой, в то
время как активатор оказывал
противоположный эффект. При более
высокой концентрации активатора график
в целом приобретает характер гиперболы.
Это указывает на то, что аллостерический
ингибитор увеличивает уровень субстратной
кооперативности, в то время как активатор
уменьшает его.
K-системы и V-системы Как видно из графика все линии стремятся к одному значению Vmax, но при этом эффектор влияет на связывание субстрата, что отмечено в изменении Км. Такая ситуация названа K-системой. Некоторые ферменты имеют эффекторы, которые изменяют Vmax. Тогда говорят о V-системе..
Двухфазный ответ на конкурентные ингибиторы. Помимо взаимодействия с эффекторами, аллостерические ферменты являются объектом обычного конкурентного торможения, подобно любому другому ферменту. Классические конкурентные ингибиторы действуют, потому что они структурно подобны субстрату фермента. В аллостерическом ферменте, с положительной субстратной кооперативностью конкурентный ингибитор также достаточно близок по строению субстрату, мог бы иметь те же самые свойства кооперативности как и субстрат. В этом случае, низкая концентрация конкурентного ингибитора увеличивает способность фермента связывать молекулы субстрата, что фактически равно увеличению скорости реакции. При более высоких концентрациях ингибитора это блокировало бы связывание субстрата обычным способом, и реакция замедлится. Ингибитор тем самым оказывает двухфазный эффект. При низких концентрациях - он действует как активатор, в то время как при высоких концентрациях, он действует как ингибитор.
Денатурирующие агенты. Денатурация – нарушение пространственной структуры фермента с последующей потерей активности фермента. Денатурация вызывается рядом факторов, включая высокую температуру, экстремальные значения рН и химические денатурирующие реактивы типа мочевины.
Аллостерические ферменты, подвергнутые умеренному воздействию одним из этих факторов денатурации часто вначале теряют свои аллостеричесие свойства (субстратную кооперативность) при сохранении способности катализировать реакции. Это хорошее доказательство того, что третичная структура играет ведущую роль не только для механизмов катализа, но для механизмов аллостерической регуляции.
Две модели объясняют механизмы аллостерии.
Предложены две основные модели, описывающие механизмы аллостерии: согласованный механизм аллостерических взаимодействий или симметричная модель, предложенная Жаком Моно, Джефри Уайменом и Жаном-Пьером Шанже в 1965 году , и последовательная модель, предложенная Даниелом Кошландом. В основном эти модели лишь крайние формы представлений о механизме работы аллостеричеких ферментов.. Главное различие между ними в том, что симметричная модель представляет мультимерный аллостерический фермент как объединение нескольких субъединиц, согласованно изменяющих свою конформацию, в то время как модель Кошланда учитывает сосуществование смешанных, или гибридных молекул, субъединицы которых могут находится в различных конформационных состояниях.
Симметричная модель. Симметричная модель аллостерии является простым и изящным объяснением положительной субстратной кооперативности и влияния аллостерических эффекторов. Она основана на идее, что аллостерический фермент состоит из ряда субъединиц, которые могут существовать в двух различных конформациях. Их обозначают как расслабленное или R-состояние, и напряженное или T-состояние.
В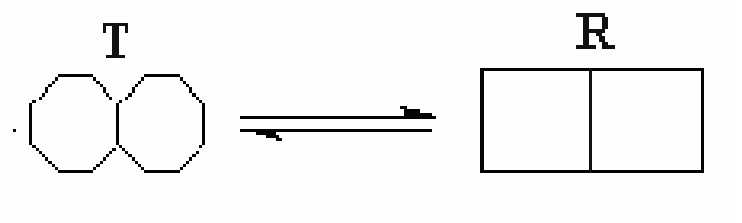 се
субъединицы данной молекулы фермента
должны иметь одну и ту же конформацию.
Другими словами, молекула фермента
должна состоять полностью из R
субъединиц или T субъединиц,
и не может содержать смесь этих форм.
В растворе эти две формы находятся в
равновесии. Поскольку смесей типов
субъединиц в индивидуальном белке
невозможны, в растворе возникает
простое равновесие между белками,
состоящими полностью из R
и T субъединиц.
се
субъединицы данной молекулы фермента
должны иметь одну и ту же конформацию.
Другими словами, молекула фермента
должна состоять полностью из R
субъединиц или T субъединиц,
и не может содержать смесь этих форм.
В растворе эти две формы находятся в
равновесии. Поскольку смесей типов
субъединиц в индивидуальном белке
невозможны, в растворе возникает
простое равновесие между белками,
состоящими полностью из R
и T субъединиц.
Для объяснения работы модели нужно сделать еще два предположения:
-
Во-первых в растворе и в отсутствии любых лигандов (субстрата или аллостерического эффектора) равновесие сдвинуто в сторону T-формы.
-
Во-вторых, конформация активных центров такова, что R-состояние имеет более высокое сродство к лиганду. Это не обязательно означает, что T форма неспособна к связыванию лиганда, просто у нее более низкое сродство.
Е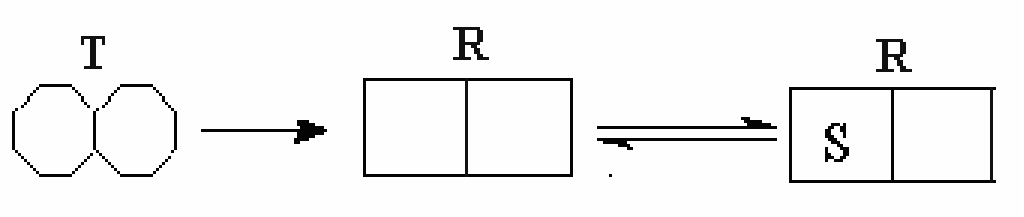 сли
добавляется небольшое количество
лиганда к этому раствору, более вероятно,
что он свяжется с R белком,
поскольку тот имеет более высокое
сродство. Это приведет к образованию
комплекса, в котором белок R
со связанной молекулой лиганда, утратит
способность переходить в Т форму, что
сместит сложившееся равновесие вправо,
увеличив число R белков
с высоким сродством к лиганду и увеличив
тем самым общее сродство к лиганду в
системе. Результат - положительная
кооперативность - связывание одной
молекулы лиганда а увеличивает
способность белка, связывать другие
молекулы лигандов.
сли
добавляется небольшое количество
лиганда к этому раствору, более вероятно,
что он свяжется с R белком,
поскольку тот имеет более высокое
сродство. Это приведет к образованию
комплекса, в котором белок R
со связанной молекулой лиганда, утратит
способность переходить в Т форму, что
сместит сложившееся равновесие вправо,
увеличив число R белков
с высоким сродством к лиганду и увеличив
тем самым общее сродство к лиганду в
системе. Результат - положительная
кооперативность - связывание одной
молекулы лиганда а увеличивает
способность белка, связывать другие
молекулы лигандов.
А ллостерические
эффекторы. Влияние эффекторов на
ферменты можно объяснить просто,
добавив к сказанному выше, что у фермента
есть два центра связывания лигандов.
Роль одного лиганда будет выполнять
субстрат, взаимодействующий с активным
центром, а второй лиганд – эффектор,
связывающийся со специальным
аллостерическим центром. Субъединицы
фермента также могут принимать или R
или T конформации. Активатор
хорошо связывается с ферментом, который
находится в R-конформации,
обладающей одновременно высоким
сродством к субстрату. Связывание
активатора смещает равновесие в сторону
R конформации с высоким
сродством к субстрату, что способствует
повышению скорости реакции.(«носок»
на сигмовидной кривой). Чем выше
концентрация активатора, тем выше
скорость реакции и тем более похожей
на гиперболу становится график
зависимости скорости реакции от
концентрации субстрата (сглаживание
«носка» на кривой), и при больших
количествах активатора на графике
возникает гипербола. Эффектор со
свойствами ингибитора имеет более
высокое сродство к T-конформации.
Его присоединение смещает равновесие
в противоположном направлении, к
появлению в растворе ферментов с низким
сродством к субстрату и уплощению и
удлинению «носка» на графике .
ллостерические
эффекторы. Влияние эффекторов на
ферменты можно объяснить просто,
добавив к сказанному выше, что у фермента
есть два центра связывания лигандов.
Роль одного лиганда будет выполнять
субстрат, взаимодействующий с активным
центром, а второй лиганд – эффектор,
связывающийся со специальным
аллостерическим центром. Субъединицы
фермента также могут принимать или R
или T конформации. Активатор
хорошо связывается с ферментом, который
находится в R-конформации,
обладающей одновременно высоким
сродством к субстрату. Связывание
активатора смещает равновесие в сторону
R конформации с высоким
сродством к субстрату, что способствует
повышению скорости реакции.(«носок»
на сигмовидной кривой). Чем выше
концентрация активатора, тем выше
скорость реакции и тем более похожей
на гиперболу становится график
зависимости скорости реакции от
концентрации субстрата (сглаживание
«носка» на кривой), и при больших
количествах активатора на графике
возникает гипербола. Эффектор со
свойствами ингибитора имеет более
высокое сродство к T-конформации.
Его присоединение смещает равновесие
в противоположном направлении, к
появлению в растворе ферментов с низким
сродством к субстрату и уплощению и
удлинению «носка» на графике .
Симметричная модель объясняет свойства аллостерических ферментов простым и изящным способом, однако свойства некоторых ферментов лучше объясняются последовательной моделью.
Последовательная модель. Симметричная модель была основана на условии, что одна молекула фермента содержит только один тип субъединиц - R или T. Последовательная гипотеза обращается к возможности существования смешанных ферментов , содержащих оба типа. Равновесие лишь достигается в растворе, в котором законченные R и T структуры просто представляют экстремальные значения:
В основе связывания субстрата - индуцированное взаимодействие.
Последовательная модель принимает, что субстрат оказывает более прямое влияние на форму фермента. В отсутствии субстрата фермент существовал бы более или менее полностью в T-форме, которая имеет очень низкое сродство к субстрату. Так как субстрат входит в активный центр, как обычно путем случайного столкновения, отдельные части молекулы белка фермента самостоятельно обхватывают субстрат, обеспечивая хорошее взаимодействие. Это известно как индуцированное взаимодействие. Процесс индуцированного взаимодействия способствует переходу субъединицы, с которой связался субстрат в R-конформацию.
Изменение конформации одной субъединицы индуцирует изменения структуры другой
Одна субъединица теперь была преобразована в R-форму, но другие - все еще в T-состоянии. Отметим, что эти субъединицы связаны друг с другом и взаимодействуют друг с другом. Если мы принимаем, что переход одной субъединицы из T состояния в R оказывает влияние на переход в состояние R других субъединиц, мы говорим о положительной кооперативности в действии субстрата, поскольку большее количество субъединиц, вероятно, перейдет в состояние с более высоким сродством к субстрату. Это изменение для других субъединиц может происходить до связывания субстрата или просто облегчать индуцированное взаимодействие при приближении молекулы субстрата.
Ингибиторы и активаторы. Влияние аллостерических эффекторов можно также легко объяснить. Активатор подобен в своем действию субстрату только уже при связывании с другим центром на субъединице, в то время как ингибитор будет делать фермент более жестким, и затрудняет индуцированое взаимодействие при переходе от Т до R.
Отрицательная субстратная кооперативность. Отрицательная субстратная кооперативность встречается не часто, но это происходит у некоторых ферментов. Симметричная модель не может объяснить отрицательную субстратную кооперативность, так как на основе закона действующих масс трудно объяснить перемещение R T равновесия в сторону высокого сродства. Последовательная модель объясняет это совершенно легко. Нужно только принять, что взаимодействие между субъединицами - таково, что преобразование одной из них в R-форму вызванную индуцированным взаимодействием делает это более трудным для других субъединиц.
Какая гипотеза является правильной?
Существование отрицательной кооперативности дает право предположить, что последовательная гипотеза более реальна. С другой стороны существование смесей Т и R субъединиц ведет к намного более сложному равновесию. Некоторые исследования, используя быстрые методы измерения скорости реакции, предполагают, что функция некоторых ферментов лучше объясняется с позиций симметричной модели. В некоторой мере гипотеза симметрии может быть рассмотрена как частный случай последовательной, в котором T/R комбинации могут существовать лишь на протяжении очень короткого времени.
Ингибиторы бывают разные: обратимые и необратимые
Вещества со свойствами ингибиторов ферментов можно грубо разделить на обратимые и необратимые. Обратимые ингибиторы связываются с ферментом, используя слабые связи, подобные тем, которые используются ферментом в связывании субстрата. Эти связи формируются быстро, но также быстро и легко разрушаются. Следствием такого связывания обратимого ингибитора является эффективное мгновенное действие, но после удаления ингибитора фермент сохраняет свою активность. Ингибитор находится в равновесии с ферментом, формируя комплекс ингибитора фермента:
С![]() тепень
торможения зависит от количества
фермента, связавшегося с ингибитором,
т.е. от позиции равновесия.
тепень
торможения зависит от количества
фермента, связавшегося с ингибитором,
т.е. от позиции равновесия.
Н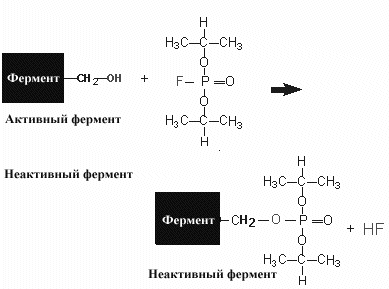
![]() еобратимые
ингибиторы известны также как инактиваторы
фермента. Они связываются с ферментом,
формируя прочные, обычно ковалентные
связи:
еобратимые
ингибиторы известны также как инактиваторы
фермента. Они связываются с ферментом,
формируя прочные, обычно ковалентные
связи:
Реакция практически необратима и фермент теряет свою активность. Учитывая, что ковалентные связи образуются медленнее, для проявления действия необратимого ингибитора требуется некоторое время для взаимодействия с ферментом. Следовательно, действие необратимого ингибитора обычно зависит от времени и степень торможения увеличивается со временем контакта его с ферментом.
Многие необратимые ингибиторы нашли применение в исследовании ферментов и медицине.
Среди примеров необратимо действующих ингибиторов можно назвать диизопропилфторфосфат (ДИПФФ). Это соединение вошло в историю энзимологии как соединение использовавшееся для исследования роли химических групп в в структуре активного центра. ДИПФФ ковалентно связывается с гидроксильной группой серина и если эта группа важна в катализе реакции, фермент терял свою активность. Эти исследования позволило выявить группу ферментов, в активном центре которых активную роль играет серин (сериновые протеазы)
Другое соединение
иодацетамид, образует ковалентную
связь с SH –группами
цистеина и если эта аминокислота важна
для активности фермента, такой фермент
утрачивает активность.
Ацетилсалициловая кислота (известный всем аспирин) является необратимым ингибитором циклооксигеназы- фермента участвующего в синтезе простагландинов. Ингибитором синтеза протеогликанов стенки бактерий является пенилиллин, структура которого напоминает D-аланин, встраиваемый в структуру протеогликанов. Связываясь с активным центром фермента бактерии благодаря своей схожести с переходным состоянием промежуточного продукта в активном центре, пенициллин образует ковалентную связь и тормозит работу фермента.
Обратимые ингибиторы могут быть конкурентными и неконкурентными
Различия между этими типами обратимых ингибиторов касаются их взаимоотношений с субстратом. Если ингибитор конкурирует с субстратом за место связывания на ферменте и действие одного может быть отменено избытком другого, говорят о конкурентном торможении, в противном случае речь идет о неконкурентных ингибиторах.
Конкурентные ингибиторы не всегда структурно подобны субстрату.
Различают два механизма конкурентного торможения.
А.Конкурентное торможение путем связывания активного центра. Классический конкурентный ингибитор - вещество, которое имеет структурное сходство с субстратом фермента. Благодаря этому подобию ингибитор может связываться с активным центром вместо субстрата. Это своеобразная молекулярная ошибка. Однако, поскольку субстрат и ингибитор не идентичны полностью, фермент не способен катализировать превращение ингибитора в продукт. Ингибитор просто блокирует активный центр фермента. Если субстрат свяжется с активным центром раньше, чем ингибитор, ингибитор не может связаться с ферментом. Нельзя одновременно обоим связаться с активным центром. Такой способ конкурентного торможения получил название изостерического из-за схожести (изос) структур субстрата и ингибитора. Наиболее часто в клетке в роли классического конкурентного ингибитора выступает продукт данной реакции, что имеет глубокий практический смысл.
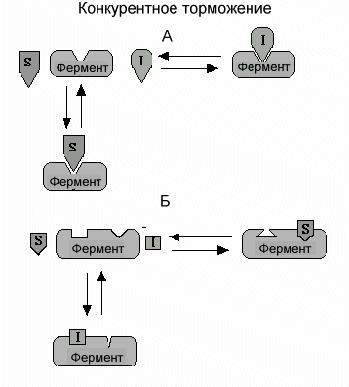 Б. Конкурентное
торможение путем изменения конформации
фермента. В отличие от классического
варианта, ингибитор связывается не с
активным центром, а со специальным
центром, связывающим ингибитор, который
расположен вдали от активного центра.
Связывание ингибитора вызывает
изменение пространственной структуры
(изменение конформации) в области
активного центра, которое не позволяет
присоединиться субстрату. Предшествующее
связывание субстрата к активному центру
в свою очередь, вызывает изменения
конформации центра связывания
ингибитора, которое предотвращает
связывание ингибитора. И субстрат и
ингибитор не могут одновременно
связаться с ферментом. В этом виде
конкурентного торможения ингибитор
может иметь любую химическую структуру,
поскольку они связываются с различными
участками фермента.
Б. Конкурентное
торможение путем изменения конформации
фермента. В отличие от классического
варианта, ингибитор связывается не с
активным центром, а со специальным
центром, связывающим ингибитор, который
расположен вдали от активного центра.
Связывание ингибитора вызывает
изменение пространственной структуры
(изменение конформации) в области
активного центра, которое не позволяет
присоединиться субстрату. Предшествующее
связывание субстрата к активному центру
в свою очередь, вызывает изменения
конформации центра связывания
ингибитора, которое предотвращает
связывание ингибитора. И субстрат и
ингибитор не могут одновременно
связаться с ферментом. В этом виде
конкурентного торможения ингибитор
может иметь любую химическую структуру,
поскольку они связываются с различными
участками фермента.
Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
Реакции связывания
и субстрата и конкурентного ингибитора
протекают быстро и обратимы, так что
они существуют в равновесии. Позиции
этого равновесия будут зависеть от
концентраций реагентов. Учитывая, что
фермент участник обеих реакций их
равновесн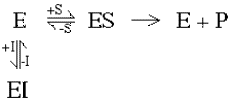 ые
состояния взаимосвязаны. Это означает,
что при высоких уровнях ингибитора
фактически все молекулы фермента будут
участвовать в образовании EI
комплекса, и фермент будет почти
полностью ингибирован. С другой стороны,
при высоких концентрациях субстрата
почти все молекулы фермента будут
связаны в ES комплексе и
ингибитор не сможет связаться с
ферментом. Высокие концентрации
субстрата снимают действие ингибитора.
Субстрат и ингибитор конкурируют
друг с другом.
ые
состояния взаимосвязаны. Это означает,
что при высоких уровнях ингибитора
фактически все молекулы фермента будут
участвовать в образовании EI
комплекса, и фермент будет почти
полностью ингибирован. С другой стороны,
при высоких концентрациях субстрата
почти все молекулы фермента будут
связаны в ES комплексе и
ингибитор не сможет связаться с
ферментом. Высокие концентрации
субстрата снимают действие ингибитора.
Субстрат и ингибитор конкурируют
друг с другом.
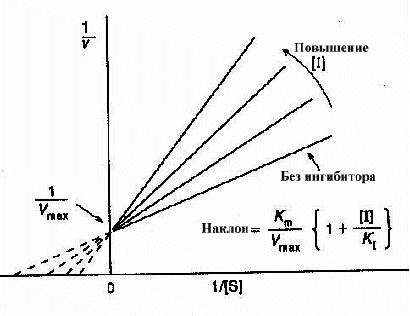
График Лаинуивера-Берка в случае классического конкурентного ингибирования
Эффект на Km Км - индикатор сродства субстрата и фермента. В присутствии конкурентного ингибитора некоторые молекулы фермента будут существовать как свободные ферменты, другие как комплексы ингибитора фермента. Первые будут иметь нормальное сродство, а вторые полностью неспособны к связыванию субстрата. Км измеряет полное сродство фермента в реагирующей смеси, которое будет представлять среднее значение между нормой и нулевым значением этого сродства, и поэтому будет явно меньше нормального значения. Так что конкурентный ингибитор уменьшает сродство субстрата и фермента, или увеличивает Км.
Эффект на Vmax Vmax - скорость при высоких концентрациях субстрата. Поскольку в этих условиях, ингибитор вытесняется субстратом, он не тормозит фермент вообще и, следовательно, конкурентные ингибиторы не замедляют реакцию при высоких концентрациях субстрата, и не изменяют Vmax. Это можно хорошо видеть на графике Лайнуивера-Берка. Наклон графика равен Km/Vmax. Увеличение наклона в присутствии ингибитора указывает на снижение скорости реакции при низких уровнях субстрата.
Наиболее часто приводимый пример конкурентного ингибирования - это использование малоновой кислоты для торможение дегидрогеназы янтарной кислоты. Наиболее близким структурным аналогом сукцината является малоновая кислота.
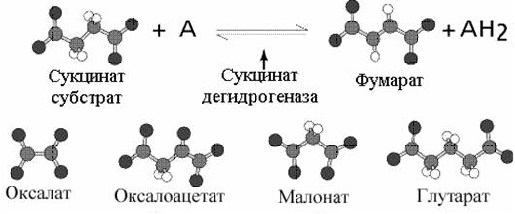
Примеры конкурентных ингибиторов.
Малоновая кислота тормозит активность дегидрогеназы янтарной кислоты, занимая активный центр на ферменте. Учитывая обратимость реакции, избыток янтарной кислоты снимет действие малоновой кислоты.
Принципы конкурентного торможения находят применение в медицинской практике.
Н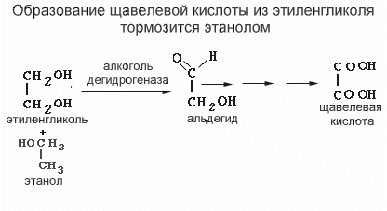 апример,
этиловый спирт используется с лечебной
целью как конкурентный ингибитор для
лечения отравлений этиленгликолем или
метиловым спиртом. В обоих случаях
проблема часто возникает среди
алкоголиков, потребляющих эти алкоголи
как дешевый заменитель этанола. Однако,
имеются другие ситуации, где может
возникать такое отравление. Производители
вина добавляют этиленгликоль к своим
винам, чтобы придать им внешний вид
более дорогих вин. В результате большое
количество ничего не подозревающих
людей могут потреблять это токсическое
соединение. Эти соединения часто
потребляются случайно взрослыми и
детьми. Животные, главным образом собаки
и коты, иногда вылизывают пролитый
антифриз из-за его особого вкуса.
апример,
этиловый спирт используется с лечебной
целью как конкурентный ингибитор для
лечения отравлений этиленгликолем или
метиловым спиртом. В обоих случаях
проблема часто возникает среди
алкоголиков, потребляющих эти алкоголи
как дешевый заменитель этанола. Однако,
имеются другие ситуации, где может
возникать такое отравление. Производители
вина добавляют этиленгликоль к своим
винам, чтобы придать им внешний вид
более дорогих вин. В результате большое
количество ничего не подозревающих
людей могут потреблять это токсическое
соединение. Эти соединения часто
потребляются случайно взрослыми и
детьми. Животные, главным образом собаки
и коты, иногда вылизывают пролитый
антифриз из-за его особого вкуса.
В таких случаях этиловый спирт - не яд, а продукт метаболизма. Алкогольдегидрогеназа катализирует образование соответствующего альдегида, который затем превращается в кислоту альдегиддегидрогеназой. Результатом этого процесса является образование формальдегида и муравьиной кислоты из метанола и глиоксаля и щавелевой кислоты из этиленгликоля. Альдегиды – основные токсические вещества , но и кислоты тоже дают нежеланные эффекты. Прежде всего, они могут вызывать ацидоз. Щавелевая кислота может кристаллизоваться в форме соли кальция в почечных канальцах, вызывая механическое повреждение.
Если затормозить эти реакции, метанол и/или этиленгликоль будут выделяться неизменяемыми. В ряде случаев это можно сделать, применяя конкурентный ингибитор. Этиловый спирт - такой ингибитор. Сродство алкогольдегидрогеназы к этиловому спирту примерно в 160 раз выше, чем к этиленгликолю. Задача врача поднять уровень этилового спирта в крови до 0.1 мг/l00 мл, что приведет к вытеснению этиленгликоля из реакции и выведению этиленгликоля с мочой.
С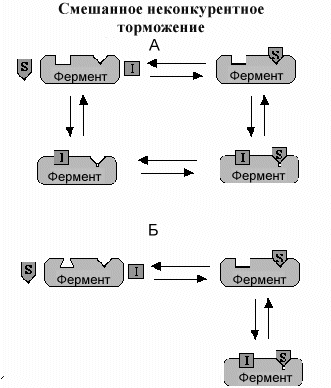 мешанные
неконкурентные ингибиторы
мешанные
неконкурентные ингибиторы
Неконкурентный ингибитор связываясь со специальным центром на ферменте, расположенным вдали от активного центра, вызывает конформационные изменения в активном центре. Это несколько напоминает один из типов конкурентных ингибиторов, но в отличие от этого механизма изменения конформации активного центра не препятствуют связыванию субстрата а тормозит проведение реакции и образование продукта..
Классический неконкурентный ингибитор не оказывает влияния на связывание субстрата. Изменения формы активного центра незначительны, хотя сродство к субстрату все же снижается. Такие ингибиторы часто называются смешанными ингибиторами, поскольку они проявляют свойства конкурентных и неконкурентных типов. Фактически классические неконкурентные ингибиторы встречаются очень редко.
Кинетика смешанных неконкурентных ингибиторов
Фермент может связываться и с субстратом и с ингибитором с образованием комплексов:
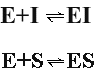
Однако в отличие от конкурентного торможения и субстрат ингибитор способны одновременно связываться с ферментом, образуя тройные комплексы:
Т акой
комплекс не способен катализировать
реакцию.
акой
комплекс не способен катализировать
реакцию.
О![]() братите
внимание, что комплекс EIS
может возникать двумя путями, но конечный
результат один и тот же - образуется
неактивный фермент. Ингибитор может
работать одинаково хорошо при низких
концентрациях субстрата, когда большая
часть молекул фермента находится в
форме свободного фермента, и при высоких
концентрациях субстрата, когда фермент
находится в форме ES
комплекса, поскольку ингибитор
связывается одинаково хорошо с обоими
из них.
братите
внимание, что комплекс EIS
может возникать двумя путями, но конечный
результат один и тот же - образуется
неактивный фермент. Ингибитор может
работать одинаково хорошо при низких
концентрациях субстрата, когда большая
часть молекул фермента находится в
форме свободного фермента, и при высоких
концентрациях субстрата, когда фермент
находится в форме ES
комплекса, поскольку ингибитор
связывается одинаково хорошо с обоими
из них.
Влияние на Km Классический смешанный неконкурентный ингибитор не оказывает влияния на связывание субстрата, сродство фермента к субстрату и следовательно не влияет на Км.
Смешанный ингибитор позволяет субстрату связываться, но снижает его сродство, так что Км повышается.
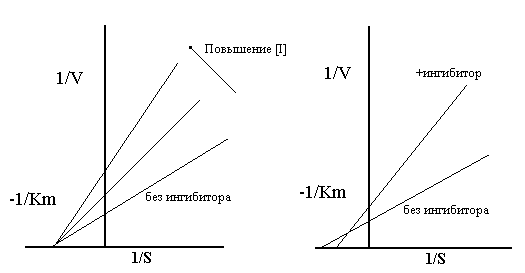
График Лаинуивера-Берка для неконкурентного классического(слева) и смешанного типов ингибиторов
Влияние на Vmax Неконкурентные и классический и смешанный варианты, тормозят активность при высоких концентрациях субстрата, так что Vmax снижается.
Влияние на Vmax/Km Неконкурентные ингибиторы могут работать при низких концентрациях субстрата так, что Vmax/Km снижается.
Г![]() рафик
Лайнуивера-Берка для типичного
классического смешанного неконкурентного
ингибитора и для смешанного неконкурентного.
На графике для смешанного конкурентного
ингибитора две линии по разному
пересекают 1/ [S], указывая
на увеличение Км, хотя на графике для
классического смешанного неконкурентного
ингибитора, значения Km
идентичны. Однако оба графика показывают
увеличение наклона в пересечении на
оси 1/V, демонстрируя, что
ингибитор является эффективным при
высоких и низких концентрациях фермента.
рафик
Лайнуивера-Берка для типичного
классического смешанного неконкурентного
ингибитора и для смешанного неконкурентного.
На графике для смешанного конкурентного
ингибитора две линии по разному
пересекают 1/ [S], указывая
на увеличение Км, хотя на графике для
классического смешанного неконкурентного
ингибитора, значения Km
идентичны. Однако оба графика показывают
увеличение наклона в пересечении на
оси 1/V, демонстрируя, что
ингибитор является эффективным при
высоких и низких концентрациях фермента.
Заключение. Смешанные неконкурентные ингибиторы связываются с центром, который является отдаленным от активного центра. Они тормозят активность фермента, вызывая изменения конформации , препятствующие превращению субстрата в продукт. Субстрат и ингибитор способны к связыванию с ферментом одновременно, образуя тройной комплекс. Это означает, что ингибитор не конкурирует с субстратом при высоких концентрациях субстрата и работает одинаково хорошо и при низких и высоких концентрациях субстрата. Правда способность связываться (сродство) с комплексом ингибитор+фермент у субстрата может снижаться, хотя на практике нет особых различий между так называемым смешанным ингибитором и классическим неконкурентным ингибитором.
Неконкурентные ингибиторы не могут связаться со свободным ферментом.
Понятие неконкурентный ингибитор часто смешивают с понятием смешанный неконкурентный ингибитор! Ингибиторы такого типа встречаются редко, хотя они имеют прямое отношение к изучению мультисубстратных ферментов.
Главная особенность этих ингибиторов - они не способны связываться со свободным ферментом. Они связываются только с фермент-субстратным комплексом. Это объясняется тем, что субстрат сам непосредственно включен в связывание ингибитора или связывание субстрата вызывает изменение конформации в связывающем ингибитор центре, облегчающее связывание ингибитора. Связывание ингибитора вызывает торможение активности фермента и превращение субстрата в продукт. Это может быть следствием прямого взаимодействия, или изменения конформации активного центра.
Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
Д![]() ля
связывания неконкурентного ингибитора,
фермент должен сначала связаться с
субстратом:
ля
связывания неконкурентного ингибитора,
фермент должен сначала связаться с
субстратом:
![]() и
только затем происходит связывание с
ингибитором:
и
только затем происходит связывание с
ингибитором:
К![]() омбинация
ингибитора со свободным ферментом:
омбинация
ингибитора со свободным ферментом:
невозможна.
Это означает, что неконкурентные ингибиторы неактивны при очень низких концентрациях субстрата, когда почти весь фермент присутствует в свободной форме. При высоких концентрациях субстрата, когда большая часть молекул фермента присутствует в форме комплекса с субстратом, ингибитор эффективен.
Влияние на Km Неконкурентные ингибиторы оказывают довольно неожиданный эффект на Км. Поскольку ингибитор связывается с комплексом субстрата и фермента, он эффективно уменьшает концентрацию этого комплекса, превращая часть его в тройной EIS. По закону действующих масс это способствует смещению равновесия субстрат связывающей реакции вправо и тем самым ингибитор увеличивает количество субстрата, который связывается с ферментом, давая очевидное увеличение сродства фермента к субстрату и уменьшение Км.
Эффект на Vmax Поскольку ингибитор не вытесняется большими количествами субстрата, а наоборот, при больших количествах субстрата быстрее идет образования его комплекса с ферментом, необходимого для проявления действия ингибитора и поэтому уменьшается Vmax.
Влияние на Vmax/Km Так как эти ингибиторы не работают при низких концентрациях субстрата, Vmax/Km не меняется.
Типичный график Лаинуивера - Берка для неконкурентного ингибитора представлен на рис. 2-12.
Вывод. Неконкурентные ингибиторы могут связываться только с комплексом субстрат-фермент, но не со свободным ферментом. В результате они не действуют при очень низких концентрациях субстрата. Они способствуют явному увеличению сродства фермента к субстрату, поскольку большее количество субстрата связывается с ферментом для образования, правда, неактивного тройного комплекса
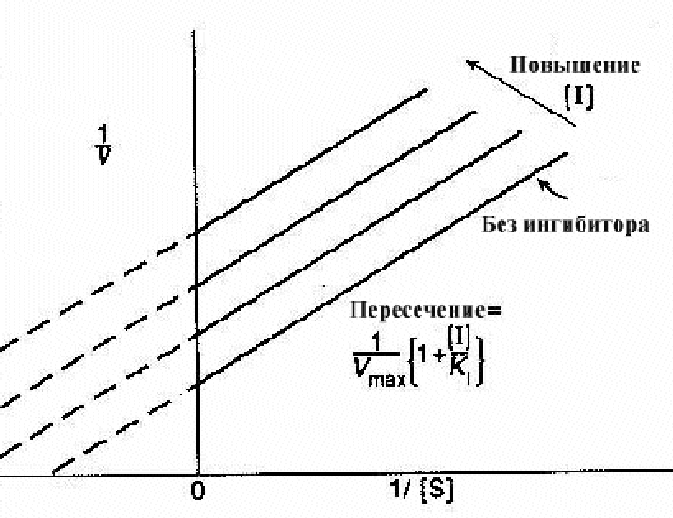
Рис 2-12. График Лаинуивера-Берка для неконкурентных ингибиторов
Торможение продуктом реакции- пример конкурентного торможения.
Заключительный этап в действии любого фермента -выделение продукта. Это важный этап в работе фермента. Продукт связан с активным центром теми же связями, которые связывали и субстрат. Это взаимодействие похоже на субстрат связывающую реакцию, и подобно этой реакции, чаще всего является очень быстрой и легко обратимой. В результате этого, молекулы продукта способны к связыванию со свободным ферментом, образуя комплекс продукта и фермента. Как и в случае действия конкурентного ингибитора, продукт и субстрат пытаются занять активный центр, но не могут связываться одновременно. Поэтому предшествующее связывание продукта предохраняет фермент от связывания с субстратом , и продукт эффективно действует как ингибитор. В ферменте, катализирующем реакцию первого порядка это специализированная форма конкурентного торможения, поскольку субстрат и продукт конкурируют друг с другом. В ферментах с больше чем одним субстратом это выглядит более сложно.
В ферментных кинетических исследованиях мы почти всегда изучаем начальные скорости, которые является скоростью реакции, начинающейся немедленно после добавления фермента к субстрату. В это период времени, конечно, продукта нет, поскольку он еще не успел возникнуть, так что мы обычно игнорируем торможение продуктом в наших кинетических исследованиях.
Субстрат может быть ингибитором фермента
О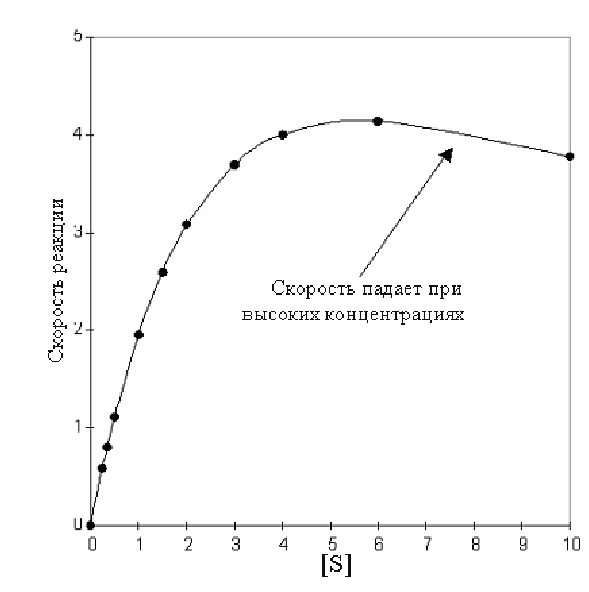 бычно
увеличение концентрации субстрата
увеличивает скорость реакции фермента.
Однако на некоторые ферменты большие
количества субстрата могут оказывать
противоположный эффект и фактически
замедлять реакцию. Примером может
служить инвертаза или -
фруктофуранозидаза (КФ.3.2.1.26), который
катализирует реакцию гидролиза
бычно
увеличение концентрации субстрата
увеличивает скорость реакции фермента.
Однако на некоторые ферменты большие
количества субстрата могут оказывать
противоположный эффект и фактически
замедлять реакцию. Примером может
служить инвертаза или -
фруктофуранозидаза (КФ.3.2.1.26), который
катализирует реакцию гидролиза
Рис 2-13. Влияние концентрации субстрата на скорость реакции
сахарозы на составляющие моносахариды глюкозу и фруктозу.
Предполагают, что причиной торможения может быть попытка двух молекул субстрата одновременно связаться с активным центром и пока молекулы субстрата связаны с активным центром фермент неактивен. Для такого связывания необходимо, чтобы вторая молекула субстрата «вставилась» в активный центр быстро вслед за первой, пока последняя не успела занять полноценную позицию для катализа. Поскольку столкновения между ферментом и субстратом полностью случайны, такое может случиться только при высоких концентрациях субстрата, когда частота случайных столкновений увеличивается, и явление торможения может быть замечено исследователем. Пример такого влияния показан на рис 2-13.
Т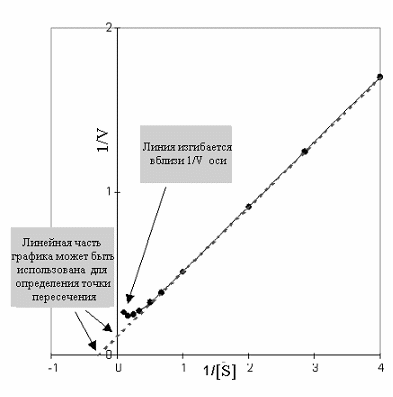 ак
как торможение субстратом происходит
при высоком уровне субстрата, начальная
часть (низкая концентрация субстрата)
этого графика идентична таковой для
нормального
ак
как торможение субстратом происходит
при высоком уровне субстрата, начальная
часть (низкая концентрация субстрата)
этого графика идентична таковой для
нормального
Рис 2-14. График Лаинуивера-Берка по данным рис 2-13.
фермента. При высоком уровне субстрата кривая снижается, что свидетельствует о торможении скорости реакции.
Так как фермент не следует предписаниям уравнения Михаэлиса и Ментен (не прямоугольная гипербола), график Лайнуивера Берка также не линеен. Поэтому вблизи оси 1/V на участке высокой концентрации субстрата, линия изгибается вверх, указывая на снижение скорости. Продолжая линейную часть графика до пересечения с осями можно определить основные кинетические параметры обычным способом.
Табл 2- 5. Эффекты обратимых ингибиторов на кинетические константы
|
Тип ингибитора |
Эффект |
|
Конкурентный (I связывается только к E) |
Увеличение Km, а Vmax остается без изменений |
|
Неконкурентный (I связывается только с ES ) |
Снижена Vmax и Km Отношение Vmax.Km остается без изменений |
|
Смешанный неконкурентный (I связывается с E или ES) |
Снижается Vmax . Km остается без изменений |
-
Регуляция активности ферментов путем химической модификации: Реакции ограниченного протеолиза, аденилирования, рибозилирования, ацетилирования, фосфорилирования (роль гормонов, АЦ-комплекса, цАМФ, цГМФ, ионов Ca).
Активность фермента можно изменить путем ковалентной модификации его структуры.
Ковалентная модификация структуры ферментов может быть обратимой и необратимой.
А. Необратимые изменения активности фермента. Существует большое число реакций, катализируемых протеолитическими ферментами. Как правило, такие ферменты образуются в форме неактивных предшественников (проферментов), которые затем активируются путем действия других протеаз. Схеме активирования химотрипсина показана ниже на рис.2-15.
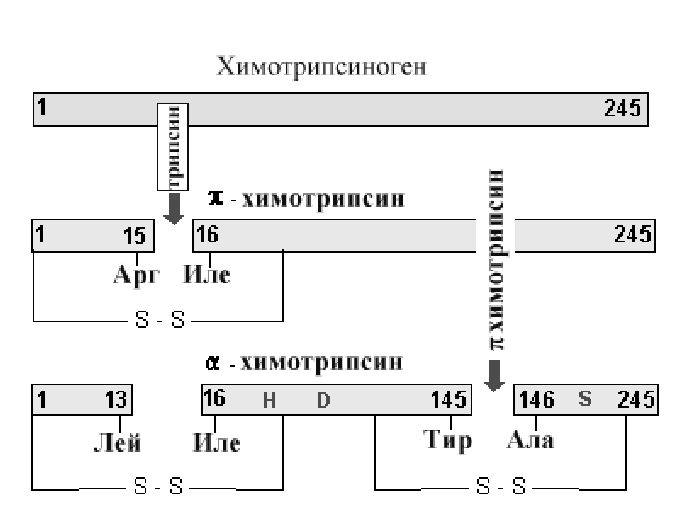
Рис 2-15. Схема протеолиза молекулы химотрипсиногена. Вначале под влиянием трипсина происходит отщепление полипептида из 15 аминокислот с образованием активного -химотрипсина, который путем аутокатализа превращается в -химотрипсин
Ниже в таблице приводятся примеры других ферментов, которые подвергаются активируются путем протеолиза
|
Фермент |
Профермент |
Место образования |
|
Трипсин |
трипсиноген |
поджелудочная железа |
|
Химотрипсин |
химотрипсиноген |
поджелудочная железа |
|
Эластаза |
проэластаза |
поджелудочная железа |
|
Карбоксипептидаза |
прокарбоксипептидаза |
поджелудочная железа |
|
Фосфолипаза А2 |
профосфолипаза А2 |
поджелудочная железа |
|
Пепсин |
пепсиноген |
желудок |
|
Тромбин |
протромбин |
свертывание крови |
|
C1r |
C1r- |
комплемент |
|
Хитин синтаза |
зимоген |
стенка клеток дрожжей |
В качестве примера можно рассмотреть ферменты поджелудочной железы. Эти ферменты синтезируются в форме проферментов клетками поджелудочной железы и сохраняются в них в составе гранул проферментов. Высвобождение проферментов регулируется гормонами холецистокинином, панкрезимином и секретином. Усвоение белков требует скоординированного действия различных ферментов. Трипсиноген активируется энтеропептидазой выделяемой клетками щеточной каймы кишечника. Энтеропептидаза катализирует удаление гексапептида (Вал Асп Асп Асп Асп Лиз) от N конца трипсиногена. Задача системы регуляции в данном случае обеспечить активирование фермента в месте его действия. Если активирование произойдет в месте синтеза, то это повлечет за собой разрушение самой железы (острый панкреатит). Небольшое количество энтеропептидазы, необходимое для активирования трипсиногена обеспечит последующее усиление (амплификацию) сигнала за счет образования больших количеств активного трипсина, который в свою очередь активирует другие протеазы кишечника. Такие цепные реакции усиления характерны для многих протеолитических систем организма (свертывание крови, система комплемента и т.д.) Процесс останавливается путем протеолиза самих ферментов Средняя ежедневная продукция короткоживущих гидролитических ферментов поджелудочной железой - около 10 г. Протеолитические ферменты широко распространены в клетках и это могло создать значительные проблемы, если бы не специальные белковые игибиторы, присутствующие в тканях и крови.
Б. Обратимые изменения активности фермента путем ковалентной модификации.
Фосфорилирование ферментов (рис 2-16) - одна из наиболее популярных реакций, позволяющая при присоединении остатка фосфорной кислоты изменить конформацию фермента и перевести фермент из активного состояние в неактивное или наоборот. Этот механизм ковалентной модификации обеспечивается киназами (присоединение остатков фосфорной кислоты за счет АТФ) и фосфатазами (гидролитическое удаление остатков фосфорной кислоты).
Более подробно об этих механизмах будет рассказано в разделах, посвященных механизму действия гормонов.
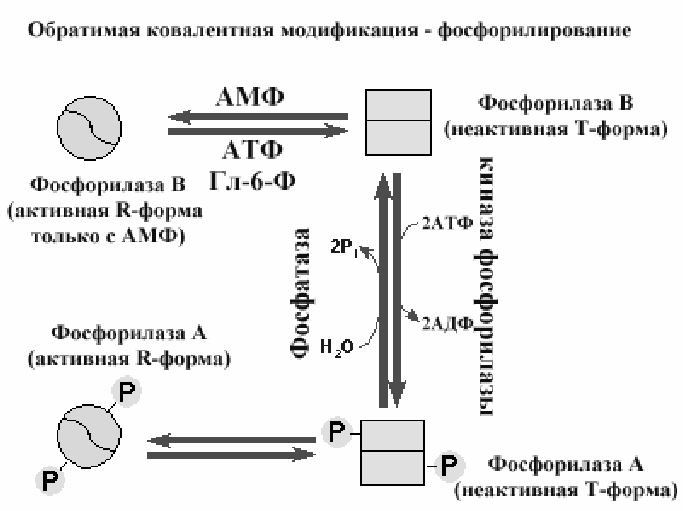
Рис 2-16. Обратимая ковалентная модификация путем фосфорилирования (киназа фосфорилазы) и дефосфорилирования (фосфатаза) фосфорилазы.
Регуляция активности с помощью гормонов.
Гормональная регуляция осуществляется на генетическом уровне путем обратного фосфорилирования. Например под действием адреналина и глюкагона происходит активация процесса распада гликогена, в ходе этого процесса образуется небелковое соединение - цАМФ, цАМФ - внутриклеточный гормон (вторичный посредник) яв-ся аллостерическим регулятором большого числа протеинкиназ. цАМФ образуется из АТФ под действием аденилатциклазы:
Гормон, циркулирующий в крови, попадает в межклеточную жидкость и контактирует с поверхностью клетки, где расположены рецепторы (Rs и Ri), белки узнающие и связывающие гормон.
Гормональный сигнал поступает на АЦ через белки посредники (Gs и Gi), которые активируются в условиях присоединения ГТФ. Уровень, образовавшийся под действием АЦ, цАМФ определяется не только активностью АЦ, но и активностью фосфодиэстераз, которые циклизируют цАМФ до АМФ.
Кроме цАМФ, существуют цГМФ, цУМФ, цЦМФ. Наибольшее значение имеет цГМФ. Она образуется под действием гуанилатциклазы, расположенной как в наружной мембране, так и внутри клетки, цГМФ единственный фермент, который реагирует на концентрацию Н2О2 и активируется под действием продуктов перекисного окисления.
цГМФ оказывает эффекты противоположные цАМФ.
цАМФ находится в тесном контакте с ионами Ca2+: высокая концентрация цАМФ в возбудимых тканях приводит к высокой [Ca2+] и стимуляции клетки. И наоборот, резкое уменьшение [Ca2+] тормозит АЦ и снижает уровень цАМФ.