
- •Федеральное агентство по образованию
- •Новгородский государственный университет
- •Квантовая оптика Сборник лабораторных работ по общему курсу физики
- •Содержание
- •Предисловие
- •1 Лабораторная работа № 4.8. Исследование вакуумного и газонаполненного фотоэлементов
- •Основные понятия и законы
- •1.2 Характеристики фотоэлементов с внешним фотоэлементом
- •1.3 Установки для исследования вакуумного и газонаполненного фотоэлементов
- •1.4 Порядок выполнения работы
- •1.5 Техника безопасности
- •1.6 Вопросы для самоподготовки
- •2. Лабораторная работа № 4.16. Исследование внутреннего фотоэффекта
- •2.1 Внутренний фотоэффект
- •2.2. Вентильный фотоэффект
- •2.3 Фотоэлементы и их характеристики
- •2.4 Описание экспериментальной установки и порядок выполнения работы
- •2.5 Техника безопасности
- •2.6 Вопросы для самоподготовки
- •3 Лабораторная работа № 4.13. Определение красной границы фотоэффекта и работы выхода электрона
- •3.1 Устройство и принцип работы монохроматора
- •3.2 Градуировка монохроматора
- •3.3 Исследование зависимости фототока от длины волны
- •4 Лабораторная работа № 4.9. Определение суммарного коэффициента поглощения тела оптическим пирометром
- •4.2.2 Законы теплового излучения
- •4.3 Методика исследования
- •4.3.1 Определение суммарного коэффициента поглощения
- •4.3.2 Измерение истинной температуры нити лампы накаливания
- •4.3.3 Электрическая схема установки
- •4.4 Порядок выполнения работы
- •5.2 Описание установки
- •5.3 Порядок выполнения работы
- •6.2 Описание установки 1
- •6.3 Порядок выполнения работы на первой установке
- •6.4 Электрическая схема второй измерительной установки и принцип ее работы
- •6.5 Порядок выполнения работы на второй установке
- •6.6 Техника безопасности
- •6.7 Вопросы для самоподготовки
- •7 Лабораторная работа №4.20. Исследование видимого спектра излучения атома водорода
- •Основные понятия и закономерности
- •7.2 Порядок выполнения работы
- •7.3 Контрольные вопросы
- •7.4 Техника безопасности
- •Библиография
- •Квантовая оптика
- •173003 В. Новгород, ул. Б. Санкт – Петербургская , 41
- •173003 В. Новгород, ул. Б. Санкт – Петербургская, 41
4.3.3 Электрическая схема установки
В данной лабораторной работе объектом исследования является нить лампы накаливания Л , включенной в цепь постоянного тока.
Схема включения приведена на рисунке 4.3

Рисунок 4.3 Блок – схема включения лампы накаливания
Лампа накаливания Л включена в цепь выпрямителя В , на вход которого подается переменное напряжение с лабораторного автотрансформатора – ЛАТРа, включенного в сеть ~220 В. Ток, протекающий через лампу, измеряется амперметром А , напряжение – вольтметром V.
Подавая с ЛАТРа различное напряжение на вход выпрямителя В, можно добиться различного свечения лампы. Энергия, потребляемая лампой за единицу времени, равна произведению тока I, протекающего через лампу, на напряжение U на лампе.
4.4 Порядок выполнения работы
-
Включить ЛАТР в сеть и постепенно увеличивать напряжение до начала свечения нити исследуемой лампы – объекта исследования.
-
Навести пирометр на излучающую поверхность исследуемой лампы.
-
Если поверхность видна не отчетливо, то перемещая объектив пирометра, добиться резкого изображения объекта исследования
Данный пункт выполняется только лаборантом или
преподавателем.
-
Включить источник ИП накала нити лампочки пирометра. Если нить пирометра видна не отчетливо, то, передвигая окуляр, добиться ее резкого изображения.
-
С помощью реостата R (поворотное кольцо с нулевой отметкой) подобрать такой накал нити пирометра, чтобы ее верхняя часть «исчезла» на фоне изображения исследуемого объекта.
-
Записать показания пирометра -Tя , а также показания амперметра I и вольтметра U , включенных в цепь исследуемого объекта – лампы накаливания.
-
По формуле (36) найти истинную температуру TT нити исследуемой лампы, считать для вольфрама
 (для λ = 0,66 мкм).
(для λ = 0,66 мкм). -
Измерения, отмеченные в пунктах 5 и 6, повторить при трех различных температурах накала нити исследуемой лампы.
-
По формуле (32) вычислить суммарный коэффициент поглощения для каждой температуры.
-
Вычислить абсолютную и относительную погрешности.
-
Результаты измерений и расчетов занести в таблицу 4.1.
Таблица 4.1
|
№ п/п |
I A |
U B |
Tя 0C |
Tя 0К |
ΔTя 0К |
TT 0К |
ΔTT 0К |
aT |
ΔaT |
|
1 2 3 4 |
|
|
|
|
|
|
|
|
|
-
Отключить установку питания объекта исследования и пирометра. Отчет по данной работе, кроме результатов измерений, должен содержать принципиальную схему устройства оптического пирометра и схему включения объекта исследований – лампы накаливания.
4.5 Техника безопасности
-
Включение установки производится только через ЛАТР с помощью тумблера «Вкл.”.
-
Запрещается касаться токоведущих частей схемы при включении в сеть ЛАТРа.
-
По окончании работы снять напряжение с ЛАТРа, а потом отключить установку.
4.6 Вопросы для самоподготовки
-
Характеристики теплового излучения.
-
Законы теплового излучения.
-
Каково устройство оптического пирометра?
-
Что такое яркостная температура?
-
Как определить опытным путем суммарный коэффициент поглощения?
-
Вывести рабочую формулу для истинной температуры и суммарного коэффициента поглощения.
5 Лабораторная работа №4.10. ИССЛЕДОВАНИЕ СПЕКТРА АТОМАРНОГО ВОДОРОДА И ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ РИДБЕРГА
Цель работы: Изучение видимой части спектра излучения атомов и определение постоянной Ридберга.
5.1 Теоретические сведения
Спектр излучения является важной характеристикой вещества, которое позволяет установить некоторые особенности его строения, свойства атомов и молекул. Спектры испускания и поглощения разных химических элементов состоят из множества линий, группы которых называются спектральными сериями. Наиболее простой спектр имеет атом водорода. Длины волн излучения описываются формулой Бальмера-Ритца:
![]() ,
(5.1)
,
(5.1)
где λ – длина волны излучения,
R – постоянная Ридберга,
n1 и n2 – целые числа, соответствующие номеру стационарного состояния атома.
Каждой серии спектра атома водорода соответствует определенное значение n1 . n2 может принимать значения от n1 +1 до +∞.
Таким образом спектр излучения водорода можно представить в виде следующих серий (рисунок 5.1).
Серия Лаймана (n1 =1) – ультрафиолетовая область спектра.
Серия Бальмера ((n1 =2) – видимая область спектра и ближняя часть ультрафиолетовой области.
Серия Пашена (n1 =3) – инфракрасная область спектра.
С ерия
Брэкета (n1 =4) -
инфракрасная область спектра.
ерия
Брэкета (n1 =4) -
инфракрасная область спектра.
Серия Пфундта (n1 =5) - инфракрасная область спектра.
Рисунок 5.1
Линия, соответствующая переходу электрона в атоме водорода с уровня n=3 на уровень n=2 в серии Бальмера является наиболее яркой и называется головной линией (первая линия каждой серии – головная).
В данной работе определяются длины волн четырех линий серии Бальмера, принадлежащих видимой области спектра. Эти линии имеют следующие обозначения:
Hα – красная линия (n2 =3),
Hβ –голубая линия (n2 =4),
Hγ – сине-голубая (n2 =5),
Hδ – фиолетовая (n2 =6).
Как известно, экспериментальные исследования спектров излучения атомов послужили основой для построения теории, объясняющей их строение и закономерности в спектрах излучения и поглощения. Попытки построить модель атома, которая смогла бы объяснить возникновение спектров испускания, были предприняты Томсоном (1903 г.), Резерфордом (1913 г.) и потерпели неудачу.
Первая попытка построения неклассической теории атома была предпринята Н.Бором в 1913 г. В основе этой теории лежала идея связать в единое целое эмпирические закономерности линейчатых спектров (формулу Бальмера), ядерную модель Резерфорда и квантовый характер излучения света (теория Планка). В теории Бора не содержалось принципиального отказа от описания поведения электрона в атоме при помощи законов классической физики. Однако Бору пришлось дополнить классическое описание состояния электрона в атоме некоторыми ограничениями. Эти ограничения были сформулированы в виде постулатов.
Первый постулат Бора (постулат стационарных состояний) заключается в следующем: из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются только некоторые дискретные орбиты, удовлетворяющие определенным квантовым состояниям, энергии которых составляют дискретный ряд: W1 ,W2,W3,...Wn. В стационарном состоянии атом не излучает.
Второй постулат Бора (правила квантования орбит): в стационарном состоянии атома электрон движется только по таким орбитам, для которых момент импульса электрона удовлетворяет условию:
![]() ,
(5.2)
,
(5.2)
где ħ – постоянная Планка, равная 1,054.10-34 Дж.с;
n=1,2,3,…; me – масса электрона;
rn – радиус соответствующей орбиты.;
vn – скорость электрона.
Третий постулат Бора (правило частот): при переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии.
Излучение происходит при переходе из состояния с большей энергией в состояние с меньшей энергией, т.е. при переходе электрона с орбиты, более удаленной от ядра, на более ближнюю к ядру:
![]() (5.3)
(5.3)
где ![]() – энергия
электрона на соответствующей орбите;
– энергия
электрона на соответствующей орбите;
![]() –
квант энергии;
–
квант энергии;
![]()
![]() – циклическая
частота излучения.
– циклическая
частота излучения.
Теория Бора дала возможность построить
модель атома водорода и водородоподобных
ионов
![]() .
Согласно этой теории атом состоит из
ядра и электрона, движущегося по круговым
стационарным орбитам. Электрон
удерживается на круговой орбите
кулоновской силой. Определим полную
энергию электрона в водородоподобном
атоме. Полная энергия электрона на
орбите складывается из кинетической
энергии электрона
.
Согласно этой теории атом состоит из
ядра и электрона, движущегося по круговым
стационарным орбитам. Электрон
удерживается на круговой орбите
кулоновской силой. Определим полную
энергию электрона в водородоподобном
атоме. Полная энергия электрона на
орбите складывается из кинетической
энергии электрона
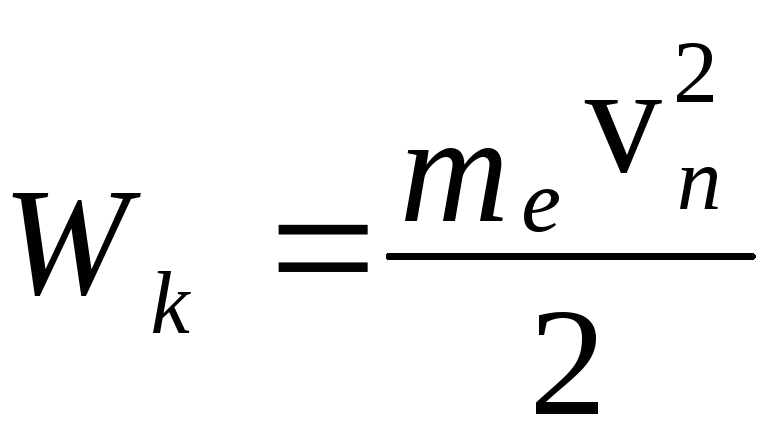 и потенциальной энергии взаимодействия
электрона с ядром
и потенциальной энергии взаимодействия
электрона с ядром
![]() ,
,
где ![]() – масса
электрона;
– масса
электрона;
![]() –
линейная скорость электрона на орбите;
–
линейная скорость электрона на орбите;
![]() – зарядовое
число ядра атома;
– зарядовое
число ядра атома;
![]() –
заряд электрона;
–
заряд электрона;
![]() – электрическая
постоянная;
– электрическая
постоянная;
![]() – радиус
орбиты.
– радиус
орбиты.
![]() .
(5.4)
.
(5.4)
Кулоновская сила сообщает электрону центростремительное ускорение, т.е.
 .
(5.5)
.
(5.5)
Из (5.5) следует, что
![]() ,
(5.6)
,
(5.6)
т.е. потенциальная энергия равна удвоенному значению его кинетической энергии:
![]() .
(5.7)
.
(5.7)
Подставив (5.5) в (5.4), получим:
![]() .
(5.8)
.
(5.8)
Для определения радиуса орбиты
![]() воспользуемся вторым постулатом Бора
воспользуемся вторым постулатом Бора
![]() и равенством (5.5). Решив систему двух
уравнений относительно
и равенством (5.5). Решив систему двух
уравнений относительно
![]() ,
получим:
,
получим:
 .
(5.9)
.
(5.9)
Таким образом rn
n2, т.е. с ростом номера орбиты
радиус ее растет. Для водорода (z=1) при
n=1:
 радиус первой боровской орбиты.
радиус первой боровской орбиты.
Подставив (5.9) в выражение (5.8), получим:
 (5.10)
(5.10)
Таким образом, из выражения (5.10) следует:
-
Полная энергия электрона в атоме отрицательна.
-
Энергия электрона в атоме принимает дискретный ряд значений, которые представлены на рисунке 5.1
При n=1 энергия минимальна, при n→∞ энергия электрона максимальна, и он покидает атом. Атом при этом ионизируется.
Воспользуемся третьим постулатом Бора и формулой энергии электрона (5.10), определим длину волны излучения при переходе электрона из одного энергетического состояния в другое.
Длина волны связана с циклической
частотой соотношением
![]() ,
где с – скорость света в вакууме.
Поскольку
,
где с – скорость света в вакууме.
Поскольку
![]() то
то
![]() ,
где
,
где
![]() – энергия
на n уровне;
– энергия
на n уровне;
![]() – энергия
на m уровне. Причем n > m.
– энергия
на m уровне. Причем n > m.
 .
(5.11)
.
(5.11)
Для длины волны формулу (5.11) можно записать в виде:
 .
(5.12)
.
(5.12)
Обозначив
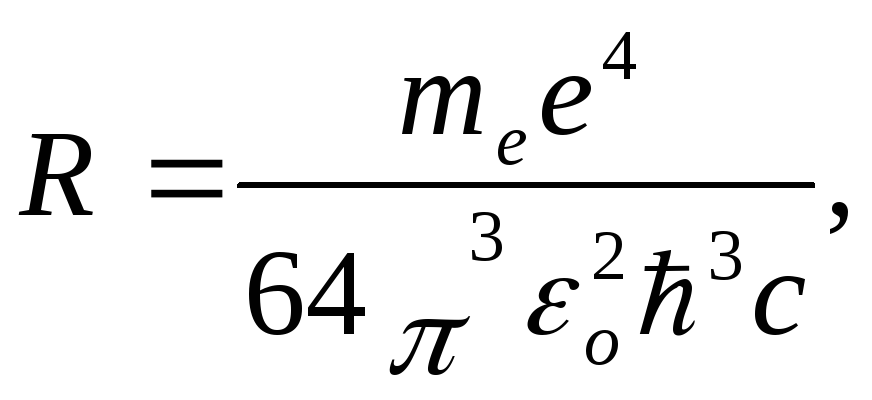 получим обобщенную формулу Бальмера:
получим обобщенную формулу Бальмера:
![]() (5.13)
(5.13)
где R – постоянная Ридберга.
Теория Бора смогла объяснить факт
испускания света атомом: при переходе
электрона из состояния с большей энергией
Wn в состояние с
меньшей энергией Wm атом
излучает квант энергии
![]() .(На
рисунке 5.2 – переходы 2 и 3).
.(На
рисунке 5.2 – переходы 2 и 3).
При поглощении порции энергии ΔW электрон переходит из основного состояния (n=1) в возбужденное (переход 1 на рисунке 5.2). В этом состоянии атом пребывает незначительный промежуток времени Δt с, а затем переходит в основное состояние, причем этот переход может осуществляться ступенчато.

Рисунок 5.2 - Возможные переходы электронов в атоме.
