
- •Лекция № 1 предмет органической химии
- •Теории химического строения
- •Основные положения теории бутлерова:
- •1. Положение о химическом строении.
- •2. Положение о зависимости свойств от химического строения.
- •3. Положение о взаимном влиянии атомов.
- •Классификация органических соединений
- •Электронные представления о природе химической связи
- •Электронная структура Схема основного электронного состояния
- •Образование ковалентной связи
- •Гибридизация электронов углерода. - и - связи.
- •Основные характеристики ковалентных связей
- •1. Полярность
- •2. Поляризуемость
- •3. Направленность связей
- •4. Длина связи
- •5. Энергия связи
- •6. Классификация органических реакций по механизму
- •Лекция № 2
- •Алифатические соединения (жирные, ациклические)
- •Способы получения предельных углеводородов
- •Лабораторные способы получения алканов
- •Пространственное строение предельных углеводородов
- •Физические свойства предельных углеводородов
- •Химические свойства предельных углеводородов
- •Получение и свойства алифатических радикалов
- •I тип. Реакция замещения
- •II тип. Реакции окисления
- •III тип. Реакции термического расщепления предельных углеводородов
- •IV тип. Изомеризация предельных углеводородов
- •Лекция 3 этиленовые углеводороды
- •Номенклатура
- •Способы получения
- •Физические свойства олефинов
- •Химические свойства олефинов
- •1. Реакции присоединения
- •Эффект Караша
- •Свойства карбкатионов
- •2. Реакции окисления
- •3. Реакции полимеризации
- •4. Реакции аллильного замещения
- •Отдельные представители
- •Лекция 4 диеновые углеводороды
- •Способы получения
- •Особенности электронного строения диенов с сопряженными связями
- •Физические свойства
- •Химические свойства
- •1. Реакции присоединения
- •2. Реакции окисления
- •3. Реакции полимеризации
- •Натуральный и синтетический каучук
- •Лекция 5 ацетиленовые углеводороды
- •Лабораторные методы получения ацетиленовых углеводородов
- •II. Реакции окисления
- •III. Реакции полимеризации и конденсации
- •Реакции замещения водорода металлом – образование ацетиленидов
- •Изомерия
- •Номенклатура
- •Способы получения
- •Электронное строение
- •Физические свойства
- •Химические свойства
- •I.Реакции нуклеофильного замещения
- •Реакции отщепления галогена
- •III. Реакции отщепления галогеноводорода
- •Лекция 7 галогенопроизводные непредельных углеводородов
- •I. Галогенопроизводные винильного типа. Получение
- •Особенности свойств
- •II. Соединения аллильного типа Получение
- •Получение
- •Отличие в физических и химических свойствах фторуглеводородов
- •Лекция 8 спирты (оксисоединения)
- •Свойства
- •Отдельные представители
- •Многоатомные спирты
- •Способы получения (кроме общих)
- •Физические свойства
- •Химические свойства
- •Рациональная система названий
- •Номенклатура iupac
- •Гомологический ряд предельных монокетонов
- •Способы получения
- •Электронное и пространственное строение карбонильных соединений
- •Физические свойства
- •Химические свойства
- •Лекция 10
- •III. Реакции окисления и восстановления
- •Реакции восстановления
- •Классификация
- •Предельные одноосновные кислоты. Гомологический ряд
- •Изомерия
- •Номенклатура
- •Способы получения
- •1. Окисление углеводородов
- •3. Электронное строение
- •4. Физические свойства предельных одноосновных карбоновых кислот
- •5. Химические свойства карбоновых кислот
- •1) Кислотные свойства
- •4) Дегидратация кислот
- •5) Декарбоксилирование – отщепление со2.
- •Лекция 12 предельные двухосновные кислоты
- •Отличие в свойствах
- •Непредельные кислоты
- •Отличия в свойствах
- •Основные особенности геометрической изомерии
- •Номенклатура
- •Получение
- •Электронное строение нитросоединений
- •Физические свойства
- •Химические свойства
- •1.Определение и классификация
- •2. Изомерия, номенклатура
- •Номенклатура
- •Физические свойства
- •Химические свойства
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Лекция 16 оптическая изомерия Оптическая активность
- •Динамическая стереохимия
- •Стереохимия нуклеофильного замещения
- •Стереохимия электрофильного присоединения
- •Стереохимия отщепления
4) Дегидратация кислот
O O
CH3-C CH3-C
OH O
OH
![]() H2O
+ CH3-C
H2O
+ CH3-C
CH3-C Kat O
O
ангидрид уксусной кислоты
Реакция требует очень высокой температуры, поэтому чаще ангидриды кислот получают взаимодействием солей с хлорангидридами.
O O
CH3-C CH3-C
ONa
![]() NaCl + O
NaCl + O
Cl CH3-C
CH3-C O
O
5) Декарбоксилирование – отщепление со2.
У предельных одноосновных кислот идет трудно и требует высокой температуры и присутствия щелочи. В результате образуется углеводород.
O
CH3-C
+ NaOH
![]() Na2CO3
+ CH4
Na2CO3
+ CH4
![]()
ONa
6) Окисление.
Предельные одноосновные кислоты к окислению устойчивы, за исключением муравьиной кислоты, которая проявляет свойства альдегидов.
O O
H-C
+ O
![]() HO-C-OH
HO-C-OH
![]() CO2
+ H2O
CO2
+ H2O
H
7) Реакции в радикале.
O O
CH3-C
+ Cl2
![]() ClCH2-C
ClCH2-C
OH OH
Лекция 12 предельные двухосновные кислоты
|
HOOC-COOH |
щавелевая |
этандионовая |
|
HOOC-CH2-COOH |
малоновая |
пропандионовая |
|
HOOC-CH2-CH2-COOH |
янтарная |
и т.д. |
|
OOC-(CH2)3-COOH |
глутаровая |
|
|
OOC-(CH2)4-COOH |
адипиновая |
|
Отличие в свойствах
1. Кислотные свойства более сильные. Степень диссоциации тем выше, чем ближе две группы СООН.
К1 щавелевая = 3,8.10-2
К1 адипиновая = 3,9.10-5
2. Образуют кислые и средние соли, полные и неполные амиды, хлорангидриды, сложные эфиры.
3. Неустойчивы к нагреванию - разлагаются
а) щавелевая и малеиновая кислоты отщепляют СО2 (декарбоксилируются) с образованием одноосновных кислот.
HOOC-COOH
![]() CO2
+ HCOOH
CO2
+ HCOOH
б) янтарная и глутаровая кислоты образуют циклические ангидриды
O O
CH2-C CH2-C
OH O
OH
![]() H2O
+ CH2-C
H2O
+ CH2-C
CH2-C O
O
в) адипиновая кислота и следующие при нагревании отщепляют и СО2, и воду, образуя циклические кетоны.
O
CH2-CH2-C
OH CH2-CH2
OH
![]() CO2
+ H2O
+ C=O
CO2
+ H2O
+ C=O
CH2-CH2-C CH2-CH2
O циклопентанон
Реакция идет легче, если взять кальциевую соль кислоты (выделяется СаСО3).
4. Двухосновные кислоты, в отличие от одноосновных, могут окисляться.
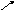 O
CO2
O
CO2
H O-C=O
O-C=O
![]() CO2
+ HO-C
CO2
+ HO-C
HO-C=O OH H2O
5. Малоновая кислота отличается особой подвижностью атомов водорода в метиленовом мостике. Н – приобретает способность замещаться. Например, диэтиловый эфир малоновой кислоты при действии металлического натрия дает замещение Н на Na.
+![]() H +
H +![]()
HOOC![]() C
C![]() COOH
COOH
H
O O
C C
OC2H5 OC2H5
CH2
+ 2Na
![]() H2
H2![]() +
2 CHNa
+
2 CHNa
O O
C C
OC2H5 OC2H5
натриймалоновый эфир
На его основе получают различные кислоты, например,
COOC2H5 COOC2H5
CHNa
+ Br-CH2-CH3
![]() NaBr + CH-CH2-CH3
NaBr + CH-CH2-CH3
![]()
COOC2H5 COOC2H5 -2C2H5OH
O
C
OH
![]() CH-CH2-CH3
CH-CH2-CH3
![]() CO2
+ CH3-CH2-CH2-COOH
CO2
+ CH3-CH2-CH2-COOH
O масляная кислота
C
OH
6. Поликонденсация двухосновных кислот с двухатомными спиртами и диаминами
O O O O
nC-(CH2)4-C
+n HO-CH2-CH2-OH
![]() n H2O
+ (-C-(CH2)4-C-O-CH2-CH2-O-)n
n H2O
+ (-C-(CH2)4-C-O-CH2-CH2-O-)n
HO OH
адипиновая килота этиленгликоль этиленгликольадипинат
O O O O
nC-(CH2)4-C
+ nH2N-(CH2)6-NH2
![]() nH2O
+ (-C-(CH2)4-C-NH-(CH2)6-NH-)n
nH2O
+ (-C-(CH2)4-C-NH-(CH2)6-NH-)n
HO OH
полиамиды (найлон 66)
