
- •Лекция № 1 предмет органической химии
- •Теории химического строения
- •Основные положения теории бутлерова:
- •1. Положение о химическом строении.
- •2. Положение о зависимости свойств от химического строения.
- •3. Положение о взаимном влиянии атомов.
- •Классификация органических соединений
- •Электронные представления о природе химической связи
- •Электронная структура Схема основного электронного состояния
- •Образование ковалентной связи
- •Гибридизация электронов углерода. - и - связи.
- •Основные характеристики ковалентных связей
- •1. Полярность
- •2. Поляризуемость
- •3. Направленность связей
- •4. Длина связи
- •5. Энергия связи
- •6. Классификация органических реакций по механизму
- •Лекция № 2
- •Алифатические соединения (жирные, ациклические)
- •Способы получения предельных углеводородов
- •Лабораторные способы получения алканов
- •Пространственное строение предельных углеводородов
- •Физические свойства предельных углеводородов
- •Химические свойства предельных углеводородов
- •Получение и свойства алифатических радикалов
- •I тип. Реакция замещения
- •II тип. Реакции окисления
- •III тип. Реакции термического расщепления предельных углеводородов
- •IV тип. Изомеризация предельных углеводородов
- •Лекция 3 этиленовые углеводороды
- •Номенклатура
- •Способы получения
- •Физические свойства олефинов
- •Химические свойства олефинов
- •1. Реакции присоединения
- •Эффект Караша
- •Свойства карбкатионов
- •2. Реакции окисления
- •3. Реакции полимеризации
- •4. Реакции аллильного замещения
- •Отдельные представители
- •Лекция 4 диеновые углеводороды
- •Способы получения
- •Особенности электронного строения диенов с сопряженными связями
- •Физические свойства
- •Химические свойства
- •1. Реакции присоединения
- •2. Реакции окисления
- •3. Реакции полимеризации
- •Натуральный и синтетический каучук
- •Лекция 5 ацетиленовые углеводороды
- •Лабораторные методы получения ацетиленовых углеводородов
- •II. Реакции окисления
- •III. Реакции полимеризации и конденсации
- •Реакции замещения водорода металлом – образование ацетиленидов
- •Изомерия
- •Номенклатура
- •Способы получения
- •Электронное строение
- •Физические свойства
- •Химические свойства
- •I.Реакции нуклеофильного замещения
- •Реакции отщепления галогена
- •III. Реакции отщепления галогеноводорода
- •Лекция 7 галогенопроизводные непредельных углеводородов
- •I. Галогенопроизводные винильного типа. Получение
- •Особенности свойств
- •II. Соединения аллильного типа Получение
- •Получение
- •Отличие в физических и химических свойствах фторуглеводородов
- •Лекция 8 спирты (оксисоединения)
- •Свойства
- •Отдельные представители
- •Многоатомные спирты
- •Способы получения (кроме общих)
- •Физические свойства
- •Химические свойства
- •Рациональная система названий
- •Номенклатура iupac
- •Гомологический ряд предельных монокетонов
- •Способы получения
- •Электронное и пространственное строение карбонильных соединений
- •Физические свойства
- •Химические свойства
- •Лекция 10
- •III. Реакции окисления и восстановления
- •Реакции восстановления
- •Классификация
- •Предельные одноосновные кислоты. Гомологический ряд
- •Изомерия
- •Номенклатура
- •Способы получения
- •1. Окисление углеводородов
- •3. Электронное строение
- •4. Физические свойства предельных одноосновных карбоновых кислот
- •5. Химические свойства карбоновых кислот
- •1) Кислотные свойства
- •4) Дегидратация кислот
- •5) Декарбоксилирование – отщепление со2.
- •Лекция 12 предельные двухосновные кислоты
- •Отличие в свойствах
- •Непредельные кислоты
- •Отличия в свойствах
- •Основные особенности геометрической изомерии
- •Номенклатура
- •Получение
- •Электронное строение нитросоединений
- •Физические свойства
- •Химические свойства
- •1.Определение и классификация
- •2. Изомерия, номенклатура
- •Номенклатура
- •Физические свойства
- •Химические свойства
- •Способы получения
- •Физические свойства
- •Химические свойства
- •Лекция 16 оптическая изомерия Оптическая активность
- •Динамическая стереохимия
- •Стереохимия нуклеофильного замещения
- •Стереохимия электрофильного присоединения
- •Стереохимия отщепления
II. Реакции окисления
Хорошо окисляются сильными окислителями за счет разрыва тройной связи с образованием двух молекул карбоновых кислот
СН3-С![]() С-СН2-СН3
+ 3О + Н2О
С-СН2-СН3
+ 3О + Н2О
![]() СН3-С=О + СН3-СН2-С=О
СН3-С=О + СН3-СН2-С=О
ОН ОН
Метилэтилацетилен (КМnО4) уксусная пропионовая
кислота кислота
Если тройная связь у конца цепи, то образуется одна молекула карбоновой кислоты и СО2.
СН3-СН2-С![]() СН
+ 4О
СН
+ 4О
![]() СН3-СН2-СООН + СО2
СН3-СН2-СООН + СО2
пропионовая кислота
III. Реакции полимеризации и конденсации
Ацетилен легко образует низкомолекулярные полимеры. В зависимости от условий реакция полимеризации может привести к образованию различных продуктов.
-
Образование ароматических углеводородов.
СН
НС СН
НС СН
![]()
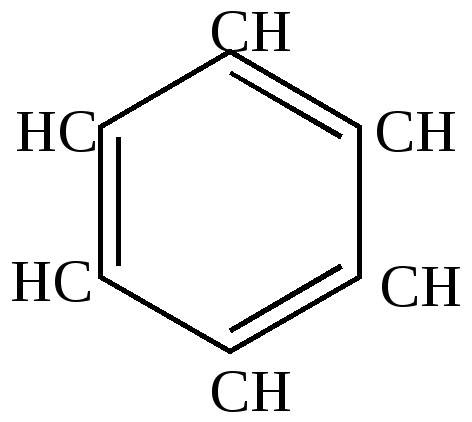
высокая температура
СН пропуск через раскаленные трубки
-
Циклическая полимеризация 4-х молекул происходит в присутствии карбонила никеля:
СН![]() СН
СН
СН СН
СН
СН
![]()
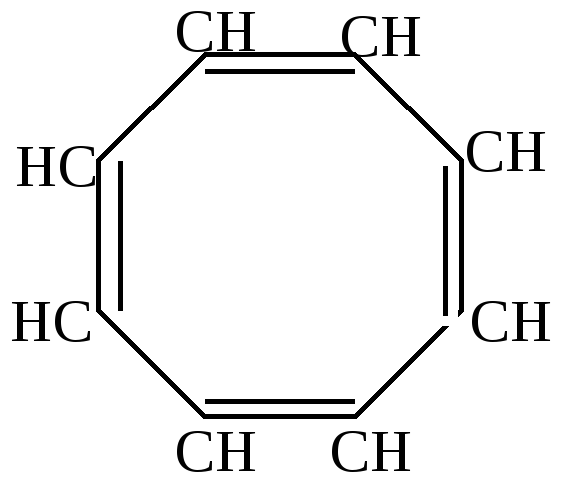
СН![]() СН
СН
-
Линейная ступенчатая полимеризация.
СН![]() СН+СН
СН+СН![]() СН
СН![]() СН2=СН-С
СН2=СН-С![]() СН
СН![]() СН2=СН-С
СН2=СН-С![]() С-СН=СН2
С-СН=СН2
винилацетилен дивинилацетилен
-
Конденсация с альдегидами или кетонами
а) реакция Фаворского
СН3 СН3
СН![]() СН
+ С-СН3
СН
+ С-СН3
![]() СН
СН![]() С-С-СН3
С-С-СН3
О ОН
диметилацетиленилкарбинол
б) реакция Реппе
СН![]() СН+СН2
СН+СН2![]() СН=СН-СН2
СН=СН-СН2![]() СН2-СН=С-СН2
СН2-СН=С-СН2
О ОН ОН ОН
пропинол бутиндиол
пропаргиловый спирт
-
Реакции замещения водорода металлом – образование ацетиленидов
1. Образование ацетиленидов щелочных и щелочно-земельных металлов.
а) взаимодействие с металлическим натрием;
б) взаимодействие с Мg-органическими соединениями:
СН3-С![]() СН+С2Н5МgBr
СН+С2Н5МgBr
![]() C2Н6 +
СН3-СН=СН-MgBr
C2Н6 +
СН3-СН=СН-MgBr
1-пропенилмагнийбромид
(реакция Иоцича)
2. Взаимодействие с гидроокисями или солями тяжелых металлов:
СН![]() СН
+ 2[Ag(NH3)2]ОН
СН
+ 2[Ag(NH3)2]ОН![]() Ag-C
Ag-C![]() C-Ag
+ 4NH3 +
2H2O
C-Ag
+ 4NH3 +
2H2O
грязно-белый осадок
СН![]() СН
+ 2[Cu(NH3)2]ОН
СН
+ 2[Cu(NH3)2]ОН
![]() Cu-C
Cu-C![]() C-Cu
+ 4NH3 + 2H2O
C-Cu
+ 4NH3 + 2H2O
красный осадок
Ацетилениды тяжелых металлов водой не разлагаются, мало химически активны, но в сухом виде взрывчаты (ацетилен нельзя пропускать через медные трубы). Реакции образования ацетиленидов металлов применяются для качественного и количественного определения углеводородов с концевой тройной связью.
Отдельные представители: ацетилен, винилацетилен.
ЛЕКЦИЯ 6
ГАЛОГЕНПРОИЗВОДНЫЕ АЛИФАТИЧЕСКИХ УГЛЕВОДОРОДОВ (алкил- и алкенилгалогениды и др.)
Это производные углеводородов, у которых один или несколько атомов водорода замещены на атом галогена. Они имеют огромное значение в науке и технике, т.к. они гораздо активнее углеводородов, с их помощью легко осуществляются переходы к другим классам органических соединений.
Классификация
-
По строению углеродной цепи (предельные и непредельные);
-
По количеству атомов галогена (моно- и полигалогенопроизводные);
-
По положению галогена (первичные, вторичные, третичные);
-
По природе галогена (фтор-, хлор-, бром- и йодпроизводные).
Моно- и полигалогенопроизводные предельных углеводородов (кроме полифторпроизводных)
Моногалогенпроизводные
СН3Cl хлористый метил
СН3I йодистый метил
С2Н5Br бромистый этил
(СН3)3СI йодистый третбутил и т.д.
Полигалогенопроизводные
СН2Cl2 хлористый метилен
CHCl3 хлороформ (хлористый метин)
CCl4 четыреххлористый углерод
CH3-CHCl2 хлористый этилиден
CH2Cl-CH2Cl хлористый этилен и т.д.
