
- •Иркутск 2005
- •Лабораторная работа 1 определение молярной массы эквивалентов цинка
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Вычисления
- •Давление насыщенного водяного пара при различных температурах
- •Лабораторная работа 2 скорость химической реакции
- •Выполнение работы
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Зависимость скорости реакции от температуры
- •Лабораторная работа 3 химическое равновесие и его смещение
- •Выполнение работы
- •Опыт 1. Влияние концентрации реагирующих веществ
- •На химическое равновесие
- •Для опыта удобно воспользоваться реакцией
- •Опыт 2. Влияние температуры на химическое равновесие
- •Лабораторная работа 4 реакции в растворах электролитов
- •Выполнение работы Опыт 1. Сравнение химической активности кислот
- •Лабораторная работа 5 гидролиз солей
- •Выполнение работы Опыт 1. Реакция среды в растворах различных солей
- •Опыт 2. Смещение равновесия гидролиза при разбавлении раствора
- •Опыт 3. Смещение равновесия гидролиза при изменении температуры
- •Опыт 4. Реакции обмена, сопровождаемые гидролизом
- •Лабораторная работа 6 окислительно-восстановительные реакции
- •П роцесс окисления
- •Выполнение работы
- •Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 2. Окислительно-восстановительная двойственность нитрита калия
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция
- •Лабораторная работа 7 химические свойства металлов
- •Выполнение работы Опыт 1. Взаимодействие металлов с водой
- •Опыт 2. Действие разбавленной и концентрированной серной кислоты на металлы
- •Опыт 3. Действие разбавленной и концентрированной азотной кислоты на металлы
- •Опыт 4. Действие щелочи на металлы
- •Лабораторная работа 8 электролиз
- •Выполнение работы
- •Лабораторная работа 9
- •Выполнение работы Опыт 1. Влияние образования гальванической пары на процесс растворения металла в кислоте
- •Опыт 2. Роль защитной пленки в ослаблении коррозии
- •Опыт 3. Защитные свойства металлических покрытий
- •Список литературы
Министерство образования и науки РФ
Федеральное агентство по образованию
Иркутский государственный технический университет
ХИМИЯ
Методические указания
к выполнению лабораторных работ
Иркутск 2005
Химия. Методические указания к выполнению лабораторных работ.
Составили: З.Н. Топшиноева, В.П. Зуева, А.Н. Волков, О.В. Лебедева. –Иркутск: 2005. - 32 с., ил.
Практикум по химии предназначен для студентов 1 курса, обучающихся по техническим направлениям и специальностям. Включает описание девяти лабораторных работ. Каждой лабораторной работе предшествует краткое теоретическое введение.
Библиогр. 5 назв. Рис. 1. Табл. 4.
Рецензент доцент кафедры химии Г.М. Белозерова
Лабораторная работа 1 определение молярной массы эквивалентов цинка
Эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять или выделять один ион водорода в кислотно-основных реакциях (или один электрон в окислительно-восстановительных реакциях). Единицей количества эквивалентов является моль. Моль эквивалентов – это количество вещества, содержащего 6,021023 эквивалентов. Масса моль эквивалентов называется молярной массой эквивалентов (МЭ) и выражается в г/моль.
Для расчета молярной массы эквивалента можно использовать формулы:
1![]() )
для элемента
)
для элемента
где МА – молярная масса атомов данного элемента; В - валентность атома
2![]() )
для сложного вещества
)
для сложного вещества
где М – молярная масса данного элемента; В - валентность функциональной группы; n – число функциональных групп в молекуле.
Для кислот функциональной группой является ион водорода, для оснований – гидроксид-ион, для солей – ион металла. Например,
![]()
![]()
![]()
![]()
Э![]() квивалент
вещества можно рассчитать по формуле:
квивалент
вещества можно рассчитать по формуле:
Н![]()
![]() апример,
апример,
Э![]()
![]() квивалент
может быть равен единице или быть меньше
единицы.
квивалент
может быть равен единице или быть меньше
единицы.
И![]() спользуя
определение молярной массы эквивалента,
можно сформулировать закон
эквивалентов:
массы
участвующих в реакции веществ
пропорциональны молярным массам их
эквивалентов.
спользуя
определение молярной массы эквивалента,
можно сформулировать закон
эквивалентов:
массы
участвующих в реакции веществ
пропорциональны молярным массам их
эквивалентов.
Выполнение работы
Один из методов определения молярной массы эквивалентов металла основан на реакции растворения металла в избытке кислоты и измерении объема выделившегося водорода. По объему водорода вычисляют его массу, а затем молярную массу эквивалентов металла.
Определение молярной массы эквивалентов металла производится в приборе, изображенном на рисунке. Прибор состоит из трех частей: колбы А, двугорлой склянки Вульфа Б и приемника В. Отверстия двугорлой склянки закрываются резиновыми пробками, через которые проходят стеклянные трубки: короткая, оканчивающаяся сразу под пробкой, и длинная, доходящая почти до дна склянки. Короткая стеклянная трубка соединяется резиновой трубкой с колбой А, а длинная - со стеклянной трубкой Г, опущенной в приемник В.
Р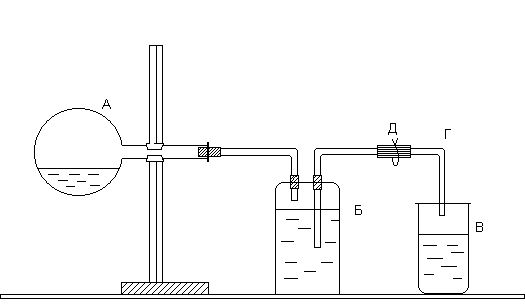 аботу
следует выполнять в следующем порядке.
Наполните водой двугорлую склянку. В
колбу налейте 10-15 мл соляной кислоты.
Закрепите колбу в горизонтальном
положении. Получите у преподавателя
навеску цинка и поместите ее в сухое
горло колбы. Закройте колбу резиновой
пробкой и проверьте герметичность
прибора. Для этого откройте зажим Д и
вдуйте воздух в прибор через стеклянную
трубку Г. В приборе создается избыточное
давление, вследствие чего вода из трубки
Г вытекает. Когда давление внутри прибора
станет равным атмосферному, вода из
трубки перестанет течь. Закройте зажим
Д. Если вода из трубки Г не уходит, прибор
герметичен. Воду из приемника вылейте
и поставьте его под трубку Г.
аботу
следует выполнять в следующем порядке.
Наполните водой двугорлую склянку. В
колбу налейте 10-15 мл соляной кислоты.
Закрепите колбу в горизонтальном
положении. Получите у преподавателя
навеску цинка и поместите ее в сухое
горло колбы. Закройте колбу резиновой
пробкой и проверьте герметичность
прибора. Для этого откройте зажим Д и
вдуйте воздух в прибор через стеклянную
трубку Г. В приборе создается избыточное
давление, вследствие чего вода из трубки
Г вытекает. Когда давление внутри прибора
станет равным атмосферному, вода из
трубки перестанет течь. Закройте зажим
Д. Если вода из трубки Г не уходит, прибор
герметичен. Воду из приемника вылейте
и поставьте его под трубку Г.
Наклоните колбу так, чтобы навеска цинка упала в кислоту, и откройте зажим. Водород, выделившийся при взаимодействии металла с кислотой, вытесняет воду из склянки Б в приемник В. Когда весь металл растворится, дайте прибору остыть, не закрывая зажима. Осторожно выньте из приемника трубку Г (следите, чтобы из нее не вылилась вода), измерьте мерным цилиндром объем воды в приемнике. Этот объем равен объему водорода, выделившегося при взаимодействии металла с кислотой. Запишите показания барометра и термометра. Исходные данные и результаты расчетов занесите в табл. 1.
Таблица 1
