
Номенклатура кислот и солей
Таблица 1.
|
Формула |
Название кислоты |
Номенклатура солей |
|
|
русская |
международная |
||
|
1 |
2 |
3 |
4 |
|
H2S |
Сероводородная |
Сернистые |
Сульфиды |
|
H2SO4 |
Серная |
Сернокислые |
Сульфаты |
|
H2SO3 |
Сернистая |
Сернистокислые |
Сульфиты |
|
H2S2O3 |
Тиосерная (серноватистая) |
Тиосернокислые (серноватистокислые) |
Тиосульфаты |
|
H3PO4 |
Ортофосфорная |
Ортофосфорнокислые |
Ортофосфаты |
|
HPO3 |
Метафосфорная |
Метафосфорнокислые |
Метафосфаты |
|
H3PO3 |
Фосфористая |
Фосфористокислые |
Фосфиты |
|
HNO3 |
Азотная |
Азотнокислые |
Нитраты |
|
HNO2 |
Азотистая |
Азотистокислые |
Нитриты |
|
H2CO3 |
Угольная |
Углекислые |
Карбонаты |
|
H2SiO3 |
Кремниевая |
Кремниевокислые |
Силикаты |
|
H3BO3 |
Ортоборная |
Ортоборнокислые |
Ортобораты |
|
HBO2 |
Метаборная |
Метаборнокислые |
Метабораты |
|
H2B4O7 |
Тетраборная |
Тетраборнокислые |
Тетрабораты |
|
HCl |
Хлористоводородная (соляная) |
Хлористые |
Хлориды |
|
HBr |
Бромистоводородная |
Бромистые |
Бромиды |
|
HI |
Йодистоводородная |
Йодистые |
Иодиды |
|
HCN |
Цианистоводородная |
Цианистые |
Цианиды |
|
H2CrO4 |
Хромовая |
Хромовокислые |
Хроматы |
|
H2Cr2O7 |
Дихромовая |
Дихромовокислые |
Дихроматы |
|
H3CrO3 |
Ортохромистая |
Ортохромистокислые |
Ортохромиты |
|
HCrO2 |
Метахромистая |
Метахромистокислые |
Метахромиты |
|
HMnO4 |
Марганцовая |
Марганцовокислые |
Перманганаты |
|
1 |
2 |
3 |
4 |
|
H2MnO4 |
Марганцовистая |
Марганцовистокислые |
Манганаты |
|
HClO4 |
Хлорная |
Хлорнокислые |
Перхлораты |
|
HF |
Фтористоводородная (плавиковая) |
Фтористые |
Фториды |
|
H3AsO4 |
Ортомышьяковая |
Ортомышьяковокислые |
Ортоарсенаты |
|
H3AsO3 |
Ортомышьяковистая |
Ортомышьяковистокислые |
Ортоарсениты |
|
CH3COOH |
Уксусная |
Уксуснокислые |
Ацетаты |
|
HCOOH |
Муравьиная |
Муравьинокислые |
Формиаты |
|
H2C2O4 |
Щавелевая |
Щавелевокислые |
Оксалаты |
|
HCN5 |
Роданистоводородная |
Роданистые |
Роданиды |
Основными методами получения кислот являются:
-
Взаимодействие неметалла с водородом с последующим растворением полученного продукта в воде:
Н2 + S = Н2S
-
Взаимодействие ангидридов кислот с водой:
SO3 + Н2O = Н2SO4
-
Взаимодействие галогенов с водой:
Cl2 + Н2O = НCl + НClО
-
Вытеснение слабых кислот из их солей более сильными кислотами:
Na2SiO3
+
Н2SO4
=
Na2SO4
+
Н2SiO3
-
окисление неметалла раствором сильной кислоты – окислителя:
3Р + 5 НNО3 + 2Н2О = 3Н3РО4 + 5NО
СОЛИ
Солями называются продукты полного или неполного замещения атомов водорода в молекуле кислоты атомами металла или гидроксильных групп в молекуле основания кислотными остатками. В связи с этим различают средние (нормальные), кислые и основные соли.
Средние соли – продукты полного замещения атомов водорода в кислоте или гидроксильных групп в основании.
Н2SO4
 Na2SO4
Na2SO4


Наименования средних солей бескислородных кислот по международной номенклатуре производится от латинского корня названия элемента – кислотообразователя с добавлением окончания «ид». Затем дается название металла с указанием его степени окисления (если металл имеет переменные степени окисления):
ВаS – сульфид бария
CuCl2 – хлорид меди (II)
NaCN – цианид натрия
CrN – нитрид хрома (III)
Mn3P2 – фосфид марганца (II)
NH4SCN – роданид аммония
Русские названия таких солей составляются из названия неметалла с окончанием «истый» («истое») и названия металла. Например:
ВаS – сернистый барий
NaCN – цианистый барий
NH4SCN – роданистый аммоний
В случае, если металл, образующий среднюю бескислородную соль, проявляет переменную степень окисления, то окончание «истый» характерно для солей с низшей степенью окисления, а для солей с более высокой степенью окисления вводится окончание «ный» («ная», «ное»). Например:
Fe2+Cl2 – хлористое железо
Fe3+Cl3 – хлорное железо
Названия средних солей кислородосодержащих кислот (HNO3, H2SO4, H3PO4, H2CO3 и др.) по международной номенклатуре складывается из латинского названия кислотообразователя с добавлением окончания «ит» (если элемент – кислотообразователь проявляет низшую степень окисления) и окончание «ат» (если элемент – кислотообразователь проявляет высшую степень окисления). Затем дается название металла в родительном падеже с указанием степени окисления (если она переменная). Так, соли H5+NO3, H2S6+O4, H3P5+O4, H2C5+O3, Н2Si4+O3 называются соответственно: нитратами, сульфатами, фосфатами, карбонатами, силикатами, а соли с азотистой H3+NO2 и сернистой H2S4+O3 – нитритами, сульфитами:
Na2SO4 – сульфат натрия
Na2SO3 – сульфит натрия
Cu SO4 – сульфат меди (II)
Cu (NO3)2 – нитрат меди (II)
Если кислотные остатки образованы элементом, обладающим различными степенями окисления, то названия образованных ими солей отличаются еще и приставками. Например, средние соли четырех кислот, образованных хлором, называются:
NaCl1+О – гипохлорит натрия;
NaCl3+О2 – хлорит натрия;
NaCl5+О3 – хлорат натрия;
NaCl7+О4 – перхлорат натрия.
Название последней соли, как и солей марганцовой кислоты (НMnO4), содержит приставку «пер». Это исторически сложившееся исключение, так как с такой приставки начинаются названия солей надкислот:
Na2S2O3 – персульфат натрия;
K2Cr2O12 – пероксохромат калия.
Если элемент образует соединения, в которых он присутствует в форме определенной функциональной группы или сложного иона (например: сульфурил, тионил и т.д.), то название соответствующих солей закачивается названием этой группы в родительном падеже:
SOCl2 – хлорид тионила;
SOF2 – фторид сульфурила.
Основными способами получения средних солей являются:
-
Взаимодействие металла с неметаллом:
Са + Cl2 = СаCl2
-
Взаимодействие металла с кислотой:
Fе + Н2SO4 = FеSO4 + Н2
-
Взаимодействие металлов с растворами солей менее активных металлов:
CuSO4 + Fе = Cu + FеSO4
-
Взаимодействие основного оксида с кислотным:
MgO + SO3 = MgSO4
-
Взаимодействие основного оксида с кислотой:
MgO + Н2SO4 = MgSO4 + Н2О
-
Взаимодействие кислотного оксида с гидроксидом:
2NaОН + SO3 = Na2SO3 + Н2О
-
Взаимодействие гидроксида с кислотой:
NaОН + НCl = NaCl + Н2О
-
Взаимодействие гидроксида (щелочи) с солью:
2NaОН
+ CuCl2
= Cu(ОН)2
 +
2 NaCl
+
2 NaCl
-
Взаимодействие кислоты с солью:
НCl
+ АgNО3
=
АgCl + НNО3
+ НNО3
-
Взаимодействие соли с солью:
ВаCl2
+
К2SO4
= ВаSO4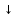 + 2КCl
+ 2КCl
-
Взаимодействие аммиака с кислотой:
2NН3 + Н2SO4 = (NН4)2SO4
Многие соли хорошо растворимы в растворителях, обладающих большими величинами диэлектрической проницаемости, например, в воде: это соли уксусной, азотной кислот, соли серной кислоты (кроме солей Са2+, Pb2+, Sz2+ и Ва2+), соли галогеноводородных кислот НCl, НВr, НI (кроме солей Аg+, Pb2+) и другие. Из солей Н2SiO3, H3PO4, Н2СO3 растворимы лишь соли щелочных металлов и аммония. (Смотри табл. 2).
За исключением солей, образованных сильными основаниями и сильными кислотами, все соли при растворении подвергаются гидролизу:
ZnCl2
+ HOH![]() ZnOHCl
+ HCl
ZnOHCl
+ HCl
В
ионном виде: Zn2+
+ HOH![]() ZnOH+
+
H+
ZnOH+
+
H+
или: Li2СО3
+ HOH![]() LiHCО3
+ LiОH
LiHCО3
+ LiОH
в
ионном виде: Li2-3
+ HOH![]() HCО-3
+ ОH-
HCО-3
+ ОH-
Для нормальных (средних) солей характерны следующие реакции, протекающие в направлении образования малорастворимых или малодиссоциированных веществ:
Растворимость некоторых веществ и оснований в воде. Таблица 2.

-
С солями: ВаCl2 + Na2SO4 = ВаSO4
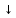 +
NaCl
+
NaCl -
С кислотами: Na2SO3 + 2HCl = 2 NaCl + Н2О + СO2
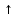
-
Со щелочами: CuCl2 + 2КОН = Cu(ОН) 2
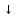 +
2КCl
+
2КCl -
С металлами (более активными, чем тот, который входит в состав соли): Нg (NО3)2 + Cu(NО3)2 + Нg
-
Термическая диссоциация: MgСO3
 MgO
+ СO2
MgO
+ СO2
Кислые соли образуют многоосновные (двух- и более) кислоты при неполном замещении их атомов водорода на металл.
Соли этого типа можно получить:
-
При взаимодействии кислоты с недостаточным количеством гидроксида: КОН + H3PO4 = КН2РО4 + Н2О
недостаток
2 КОН + H3PO4 = К2НРО4 + 2Н2О
-
При взаимодействии кислоты с недостаточным количеством основного оксида: 2H3PO4 + СаО = Са(H2PO4)2 + Н2О
-
При взаимодействии кислоты со средней солью, имеющей тот же кислотный остаток: H2SO4 + Na2SO4 = 2 Na НSO4
-
При взаимодействии щелочи или соли с ангидридом кислоты, взятом в избытке: КОН + СO2 = КН СO3
СаСO3 + СO2 + Н2О = Са (НСO3)2
Названия кислых солей составляется по международной номенклатуре аналогично названиям нормальных солей, только присутствие в молекуле соли атомов водорода отмечается приставкой «гидро» с соответствующим греческим числительным («моно»-, ди -, три - и т.д.). Числительное «моно» обычно опускается:
Са(НSO4)2 – гидросульфат кальция;
КН2РО4 – дигидрофосфат калия;
К2НРО4 – гидрофосфат калия;
Na НСO3 – гидрокарбонат натрия.
Иногда в названиях солей двухосновных кислот приставка «гидро» - заменяется приставкой «би»:
Na НСO3 – бикарбонат натрия
КНSO4 – бисульфат калия
Na НSO3 – бисульфит натрия.
Названия кислых солей в русской номенклатуре подобны названиям нормальных солей с добавлением слова кислый. Количество замещенных в кислоте атомов водорода указывается прилагательным «однозамещенный», «двузамещенный» (в случае трехосновной и выше кислоты).
Ва (Н2РО4)2 – кислый фосфорнокислый барий однозамещенный
К2НРО4 – кислый фосфорнокислый калий двузамещенный
Na НSO4 – кислый сернокислый натрий
валентность кислотного остатка в кислой среде определяется количеством атомов водорода кислоты, замещенных на атомы металла:
Mg (Н2РО4)2 – (один атом водорода в молекуле замещен на атом металла)
К2НРО4 – (два атома водорода замещены на атомы металла).
В водных растворах соли такого типа диссоциируют на положительно заряженные ионы металла (катионы) и отрицательно заряженные ионы кислого остатка (анионы):
К2НРО4
![]() 2К+
+ НРО2-4
2К+
+ НРО2-4
Са
НСО3)2
![]() Са2+
+
2НСО-3
Са2+
+
2НСО-3
В таких растворах частично присутствуют и ионы Н+, РО3-4, СО2-3.
Кислые
соли можно перевести в нормальные
действием на них избытка гидроксида:
Са (НСО3)2
+ Са (НО)2
= 2 СаСО3 + 2Н2О
+ 2Н2О
Основные соли («гидроксо» - соли) являются продуктами неполного замещения гидроксильных групп в гидроксиде кислотными остатками. Они могут быть получены:
-
из многокислотных гидроксидов при их неполной нейтрализации:
Cu (ОН) 2 + Н2SO4 = (CuОН) 2 SO4 + 2Н2О
недостаток
Са (ОН) 2 + HCl = СаОН Cl + Н2О
-
при взаимодействии средней соли с гидроксидом:
Вi(NО3)2 + 2КОН = Вi(ОН) 2NО3 + 2КNО3
недостаток
В средние соли основные соли переводятся действием на них избытка кислоты: ZnОН NО3 + НNО3 = Zn (NО3)2 + Н2О
Количество образованных данных гидроксидом основных солей зависит от его кислотности. Однокислотные гидроксиды (NаОН, КОН и т.д.) основных солей не образуют. Двухкислотным гидроксидам соответствуют основные соли одного типа:
Zn(ОН)2
 Zn
ОН Cl
Zn
ОН Cl
Ва
(ОН)2
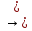 ВаОН)2
SO4
ВаОН)2
SO4
Трехкислотным гидроксидам – двух типов:
Fе(ОН)3
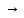 Fе(ОН)2
Cl
Fе(ОН)2
Cl
Fе(ОН)3
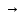 Fе
ОН Cl2
Fе
ОН Cl2
Валентность основного остатка определяется количеством гидроксильных групп в гидроксиде, замещенных кислотными остатками:
Аl(ОН)3
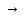 [Аl(ОН)2]+2
SO2-4
[Аl(ОН)2]+2
SO2-4
Аl(ОН)3
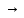 Аl
ОН2
+
SO2-4
Аl
ОН2
+
SO2-4
Диссоциация таких солей в водных растворах протекает по схеме:
[Аl(ОН)2]2
SO4
![]() 2
Аl(ОН)+2
+ SO2-4
2
Аl(ОН)+2
+ SO2-4
Аl
ОН
SO4![]() Аl(ОН)2+
+ SO2-4
Аl(ОН)2+
+ SO2-4
Русские названия основных солей составляются аналогично названиям средних солей, но при этом добавляется слово «основной» («основная», «основное») и указывается количество замещенных в гидроксиде гидроксильных групп (для многокислотных гидроксидов). Например,
(SrOH)2 SO4 – основной сернокислый стронций;
Cr(OH)2 Cl – основной хлористый хром однозамещенный;
Fe OH CO3 – основное углекислое двузамещенное железо (III)
По международной номенклатуре названия основных солей повторяют названия соответствующих средних солей с добавлением приставки «гидроксо» и с указанием с помощью греческого числительного количества гидроксильных групп в этих солях:
(SrOH)2 SO4 – гидросульфат стронция;
Cr(OH)2 Cl – дигидроксохлорид хрома (III);
Fe OH CO3 – гидроксокарбонат железа (III).
иногда при образовании основной соли происходит отщепление воды из основного остатка с выделением «оксосоли». Такие соли уже не содержат гидроксильных групп:
Вi(ОН)2 = SiOCl + Н2О
Sb(ОН)2Cl + SbОCl + Н2О
Помимо этого «оксосоли» могут образоваться в результате замещения гидроксильных групп в гидратных соединениях на кислотный остаток.
UO2(ОН)2
 UO2Cl
UO2Cl
или Н2 UO4
CrO2
(OH)2 CrO2
(NО3)2
CrO2
(NО3)2
или H2 CrO4
Названия «оксосолей» включают в себя название металла, образующего «оксо» - группу, с окончанием «ил» и латинское название соответствующей кислоты: ВiОCl – хлорид висмутила;
SbО NО3 – нитрат стибила;
UO2Cl2 – хлорид уранила;
CrO2(NО3)2 – нитрат хромила.
Особые группы солей образуют двойные, смешанные, комплексные (о них вы узнаете в соответствующем разделе практикума) соли, галогенангидриды, карбиды, нитриды, силициды, бориды.
Двойные соли образованы одной и той же кислотой, но двумя различными металлами. Формулы и названия таких солей обычно начинаются с катиона, имеющего более низкую степень окисления. Кислотный остаток называется аналогично средним солям:
NаАlF4 – фторид натрия-алюминия;
КАl(SO4)2*24 Н2О – сульфат калия-алюминия;
N H4 MgРО4 – фосфат аммония (магния).
Смешанные соли в своем составе содержат анионы различных кислот и катионы одного и того же металла. Например, соль СаCl(ClО) – соль соляной (НCl) и хлорноватистой (НClО) кислот, ВаCl(NО3) – соль соляной и азотной кислот. В соответствии с этим соль СаCl(ClО) называется хлоридгипохлорит кальция, а соль ВаCl(NО3) – хлорид-нитрат бария.
Галогенангидриды – продукты полного или неполного замещения гидроксильных групп в молекулах кислородосодержащих кислот атомами галогенов. Так, фосфористой кислоте Н3РО3 (или Р(ОН)3) соответствуют галогенангидриды РCl3, РОВr3; азотистой кислоте НNО2, (или NООН) – NОCl и т.д.
В соответствии с этим их можно назвать следующим образом:
РCl3 – трихлорангидрид фосфористой кислоты;
РОCl3 – трихлорангидрид ортофосфорной кислоты;
NОCl –хлорангидрид азотистой кислоты.
Характерным свойством для многих галогенагидридов, является их способность при взаимодействии с водой или парами воды образовывать необратимо две кислоты – галогеноводородную и соответствующую кислородосодержащую:
NОCl + Н2О = НNО2 + НCl
РВr3 + 3Н2О = Н3РО3 + 3НВr
Карбиды – соединения металлов и некоторых неметаллов с углеродом. В зависимости от характера межатомных связей карбиды делятся на четыре группы:
-
Солеобразные карбиды образуют главным образом элементы I, II, III и частично IV, V и VI групп. Их можно рассматривать как продукты замещения металлом атомов водорода в:
-
метане CH4 (Be2C, Al4C3) Be
 C
C
 Be
Be -
ацетилене CH
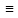 CH (CaC2,
Na2C2,
ZnC2,
Ag2C2)
CH (CaC2,
Na2C2,
ZnC2,
Ag2C2)
 Na
– C
C
– Na
Na
– C
C
– Na
-
Карбиды с ковалентной связь. (SiC, B4C3), отличающиеся тугоплавкостью, жаростойкостью, высокой твердостью и химической инертностью.
-
Карбиды – фазы внедрения атомов углерода в кристаллическую решетку из атомов металла (TiC, ZnC, VC, Mo2C, W2C).
-
Карбиды типа Fe3C (Mn3C, CO3C, Ni3C). Эти карбиды растворяются в разбавленных кислотах с выделением смеси углеродов с водородом и обладают более низкими температурами плавления и твердостью.
Основным методом получения карбидов является прокаливание при высоких температурах соответствующих металлов или их оксидов с углем в инертной Ar, He или восстановительной Н2, СО атмосфере.
Нитриды – соединения металлов и некоторых неметаллов с азотом. Подобно карбидам, они делятся по типу химической связи на несколько групп:
-
Ионные или Солеобразные нитриды. Их образуют s-элементы (щелочные и щелочноземельные металлы) и металлы подгрупп меди и цинка (Li3N, Zn3N2, Cu3N2, Вe3N2 и др.)
Li
N
 Li Zn
= N – Zn – N = Zn
Li Zn
= N – Zn – N = Zn
Li
Все представители этой группы являются полупроводниками, при высоких температурах неустойчивы, легко взаимодействуют с Cl2, F2, P с разбавленными кислотами, водородом.
-
Ковалентные нитриды (AlN, BN, Si3N4) Al N, В N образуются Р - элементами и обладают свойствами либо полупроводника, либо диэлектрика. Устойчивость их значительно выше, чем у ионных нитридов. В машиностроении в последнее время широко используется нитрид бора (боразон), обладающий твердостью, близкой к алмазу, стойкостью к нагреванию до 2000С (алмаз сгорает при 900С).
-
Металлоподобные нитриды образуются за счет ионной и металлической связи d и f – элементами (TiN, VN, CrN, Cr2N и др.). Такие связи очень прочны, так как образованы при внедрении атомов азота в кристаллическую решетку металла за счет не только внешних s-электронов, но и глубоко расположенных d –электронов. Многие металлоподобные нитриды являются хорошими сверхпроводниками, обладают высокой химической стойкостью по отношению к кислороду воздуха, кислотам, расплавленным металлам.
Получаются
нитриды либо при непосредственном
взаимодействии металлов и азота: 2Al
+ N2
 2AlN,
либо действием на оксиды металлов
азотом или аммиаком:
2AlN,
либо действием на оксиды металлов
азотом или аммиаком:
TiО2
+ 2С + ½ N2
 TiN
+ 2СО
TiN
+ 2СО
3Cu2O
+ 2NH3
 2Cu3N
+ 3H2O
2Cu3N
+ 3H2O
Силициды – соединения кремния с металлами и некоторыми неметаллами (KSi, CaSi, SiC, Si3N4, NiSi4). Силициды очень похожи на карбиды, однако они еще больше, чем карбиды приближаются к интерметаллическим соединениям. Для получения силицидов используют следующие методы:
-
непосредственное соединение металлов с порошкообразным кремнием в защитной среде инертных газов
Nа
+ Si
 NаSi
NаSi
-
взаимодействием оксидов металлов с кремнием в вакууме
ВаО
+ 2 Si
 ВаSi
+ SiО
ВаSi
+ SiО
-
восстановлением оксидов карбидом кремния
МеО + SiС = МеS + СО
Силициды Cr, Mo, W, Ti, Zr и др. играют значительную роль при создании жаропрочных сплавов, стабилизируя их при высоких температурах.
Подобными же свойствами обладают бориды этих же металлов. Бориды – соединения металлов и некоторых неметаллов (С, Si) с бором солеобразного (Mg3B2 Mg=B–Mg–B=Mg) и несолеобразного (B4C, CaB6, BaB6, AlB2 и др.) типа.
Многие бориды имеют высокую твердость, химическую стойкость, тугоплавкость (барид циркония ZsB2 плавится при 3040С).
Графические формулы солей
составляются исходя из графических формул соответствующих кислот, заменой атомов водорода в них на атомы металла (с учетом его степени окисления). Например, составление графической формулы средней соли карбоната натрия Nа2СО3 начинают с написания графической формулы угольной кислоты Н2СО3:
Н+2С4+О2-3 
затем заменяют одновалентные атомы водорода, выделенные пунктиром, на одновалентные атомы натрия:
Nа2С4+О2-3 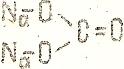
Из формулы следует, что кислород в данном соединении двухвалентен, углерод – четырех. Графическая формула соли двухвалентного металла карбоната кальция СаСО3 будет иметь вид:
Са2+С4+О2-3 
Если в составе молекулы соли несколько кислотных остатков, то ее графическая формула составляется исходя из соответствующего количества графических формул кислот:
Fe3+2 (SO4)2-3 – соль серной кислоты Н2SO4
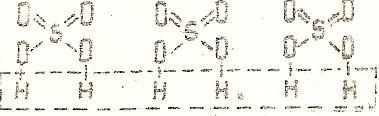
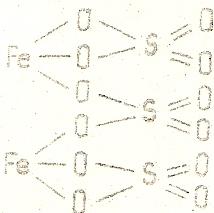
Графические формулы кислых солей, у которых в составе молекул имеются атомы водорода, незамещенные на металл, составляются аналогично формулам средних солей:
КНSO4 – гидросульфат калия
 -
один атом водорода в кислоте
-
один атом водорода в кислоте
замещен на атом калия
Fe(Н2РО4)3 – дигидроортофосфат железа (III):

В каждой из трех молекул фосфорной кислоты два атома водорода остаются в составе молекулы соли, и лишь один замещается атомом железа. В соответствии с валентностью этого металла он замещает три атома водорода (по одному в каждой из трех молекул кислоты).
Графические формулы основных солей, производных гидроксидов, составляются следующим образом: вначале пишется графическая формула гидроксида, затем соответствующее число гидроксильных групп в нем замещается на кислотный остаток. Например: СаОНNО3 – гидроксонитрат кальция
Са(ОН)2
НNО3
[Cr(OH)2]2SO4 - дигидроксосульфат хрома (III).
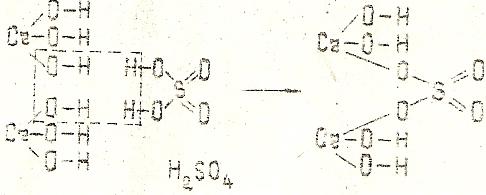
Кислотный остаток серной кислоты замещает по одной гидроксильной группе в каждой молекуле гидроксида железа (III).
(AlОН)3(РО4)2 – гидроксоортофосфат алюминия

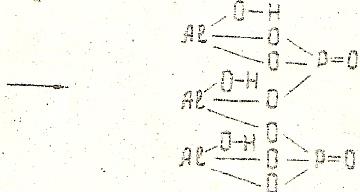
В трех молекулах гидроксида алюминия остается по одной гидроксильной группе, остальные группы ОН замещаются, соответственно, двумя кислотными остатками ортофосфорной кислоты.
