- •Российский государственный педагогический университет имени а.И. Герцена
- •Основы химического языка
- •Предисловие
- •Химическая номенклатура
- •I. Химический элемент, химическое соединение
- •1.1. Химический элемент – символы и названия, изотопы.
- •Классификация химических элементов.
- •Классификация химических соединений по составу.
- •Принципы химической номенклатуры – химическая формула и химическое название соединения.
- •Систематические и традиционные названия простых веществ.
- •Степень окисления элементов в химических соединениях.
- •Систематические и специальные названия одноэлементных ионов.
- •Систематические и специальные названия бинарных соединений.
- •Функциональная классификация сложных неорганических соединений
- •Оксиды.
- •Гидроксиды – основные (основания), амфотерные, кислотные (оксокислоты).
- •Пероксокислоты.
- •Тиокислоты, политионовые и другие замещенные оксокислоты.
- •Бескислородные кислоты.
- •Галогенангидриды.
- •Основные положения координационной теории.
- •Номенклатура комплексных соединений.
- •Соединения постоянного и переменного состава (дальтониды и бертолиды)
- •Аддукты.
- •Химические реактивы.
- •Общие правила работы в химической лаборатории, меры предосторожности и первая помощь при несчастных случаях10.
- •«Основные классы неорганических соединений. Оксиды
- •Гидроксиды
- •Кислоты
- •Металлокомплексные соединения
- •Количественные характеристики химических элементов и соединений.
- •1.17. Определение простейших и молекулярных формул соединений.
- •Лабораторная работа №2.
- •Индивидуальное домашнее задание № 1
- •II. Химический процесс
- •Химическая реакция, уравнение химической реакции
- •Ионно-молекулярные уравнения реакций с участием электролитов.
- •Окислительно-восстановительные реакции – классификация.
- •Составление уравнений окислительно-восстановительных реакций.
- •Важнейшие окислители и восстановители
- •Лабораторная работа № 3 «Окислительно-восстановительные реакции» Окислительные свойства кислот
- •Окислительно-восстановительные свойства галогенов и их соединений
- •Окислительно-восстановительные свойства металлов и их соединений
- •Влияние кислотности среды на окислительно-восстановительные свойства соединений марганца и хрома
- •Окислительно-восстановительная двойственность
- •Реакции диспропорционирования
- •Реакции внутримолекулярного окисления-восстановления
- •Эквивалент, закон эквивалентов
- •5,6 Г железа эквивалентны 3,2 г серы
- •0,644 Г koh взаимодействует с 0,471 г н2рно2
- •Лабораторная работа №4 «Определение эквивалента магния»
- •Индивидуальное домашнее задание № 2
- •Вариант 6
- •Ответы.
- •I. Химический элемент, химическое соединение.
- •II. Химический процесс.
Ответы.
I. Химический элемент, химическое соединение.
-
Химическими структурными элементами вещества являются атомы с постоянным зарядом ядра, называемые химическими элементами, и их производные – положительно и отрицательно заряженные ионы химических элементов. Химическое взаимодействие (химическая связь) между этими структурными элементами приводит к образованию разнообразных химических соединений. Химические структурные элементы с одной стороны базируются на физических структурных единицах – ядрах атомов и электронах, а с другой – являются компонентами лежащими в основе биологических (клетка) и геологических (минералы) структурных единиц вещества.
-
А. Лавуазье.
А) – 1) Br, 2) Os, 3) Сs, 4) Cl, 5) Tl, 6) Pr, 7) S, 8) Rb, 9) Rh, 10) I, 11) Zr, 12) In, 13) Ir, 14) Cr; Б) – 1) V, 2) Nb, 3) Pm, 4) Ta, 5) Ti, 6) Th; В) – 1) Se, 2) Au, 3) Pd, 4) U, 5) Np, 6) Pu, Ce; Г) – 1) N, 2) P, 3) At, 4) Tc, 5) F, 6) Ba, 7) Ar, 8) O, 9) C, 10) Dy, 11) Kr, 12) La; Д) – 1) Sr, 2) Y, Er, Yb, 3) Bk, 4) Cf, 5) Re, 6) Hs, 7) Db, 8) Eu, 9) Am, 10) Sc, Tm; Е) – 1) Ru, 2) Po, 3) Fr, 4) Ge; Ж) – 1) Ho, 2) Lu, 3) Hf; З) – 1) Gd, 2) Cm, 3) Es, 4) Fm, 5) Md, 6) Lr, 7) Nb, 8) Rf, 9) Sb, 10) Bh, 11) Mt.
-
Переходные элементы VII группы: Mn, Tc, Re – подгруппа марганца, непереходные элементы – F, Сl, Br, I, At - галогены. F и Cl – типические элементы, Br, I, At – элементы подгруппы брома.
-
Rb – непереходной s-элемент 1 группы, 5 периода, щелочной метал, подсемейство калия; Y – переходной d-элемент 3 группы, 5 периода, подгруппа скандия; Ta – непереходной d-элемент 5 группы, 6 периода, подгруппа ванадия; Be – переходной s-элемент 2 группы, 2 периода, щелочноземельный метал, типический элемент; Sg – переходной d-элемент 6 группы, 7 периода, подгруппа хрома; In – непереходной p-элемент 3 группы, 5 периода, подсемейство галлия; Ni – переходной d-элемент 8 группы, 4 периода, подгруппа железа; C – непереходной p-элемент 4 группы, 2 периода, типический элемент; Pd – переходной d-элемент 8 группы, 5 периода, семейство платиновых металлов; As – непереходной р-элемент 5 группы, 4 периода, подсемейство мышьяка; Sm – переходной f-элемент 3 группы, 6 периода, семейство лантаноидов; О – непереходной р-элемент 6 группы, 2 периода, типический элемент; халькоген; Am – переходной f-элемент 3 группы, 7 периода, семейство актиноидов; I – непереходной р-элемент 7 группы, 5 периода, подсемейство брома, галоген; Ne – непереходной р-элемент 8 группы, 2 периода, типический элемент, благородный газ.
-
Простые - соединения, состоящие из атомов одного химического элемента; сложные – соединения, состоящие из атомов разных элементов.
-
Аллотропные модификации состава: кислород O2 и озон О3, S8 и S; аллотропные модификации формы: S (ромбическая) и S (моноклиническая) отличаются кристаллическими решетками, содержащими молекулы S8.
-
Бинарные - соединения состоящие из атомов двух химических элементов. BaCl2, MgO, Ca3N2, Sr3P2, CaH2.
-
S8 – простое вещество, (SO3)3, FeS2 – бинарные соединения, SO2Cl2, Na2SO4 – многоэлементные соединения.
-
Графические формулы обоснованы для соединений с молекулярной структурой.
-
Соединение
Формула
Простейшая
Молекулярная
Графическая

Аммиак
NH3
NH3
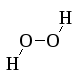
Пероксид водорода
HO
H2O2
 Азот
АзотN
N2

Белый фосфор
P
P4
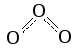
Озон
О
О3
Гелий
He
He
He
-
Cl2, Na2O, K2SO4; Ba(OH)2, K3[Fe(CN)6], (NH4)3PO4; Na2SO410H2O, 3CdSO48H2O, Cl26H2O; -Fe, -Fe, -Fe.
-
Ne – неон; Cl2 – дихлор, хлор; O2 – дикислород, кислород; S2 – дисера; S8 – октасера; Sn – полисера; N2 – диазот, азот; P4 – тетрафосфор, белый фосфор; Pn – полифосфор; B12 – додекабор.
-
S (ромб.) – ромбическая сера, S (монокл.) – моноклиническая сера.
-
Постоянные степени окисления – щелочные и щелочноземельные металлы, р-элементы III группы (за исключением Tl), F, Ag, Cd, Zn, Sc, Y, La, Ac.
-
Менделеевское правило для р-элементов IV-VII групп – для элементов четных групп наиболее характерны четные, а для элементов нечетных групп – нечетные степени окисления: N, N-2, N-4, N-6, N-8. Для элементов IV, V, VI и VI группы соответственно: +4, +2, -2, -4; +5, +3, +1, -1, -3; +6, +4, +2, -2; +7, +5, +3, +1, -1.
-
Номеру группы.
-
Fe+2, Fe+3; Co+2, Co+3; Ni+2; Cr+2, Cr+3, Cr+6; Mn+2, Mn+4, Mn+6, Mn+7; Cu+, Cu+2; Ag+; Au+, Au+3; Zn+2; Cd+2; Hg+, Hg+2.
-
OO3, N+2O-2, Ca+2O-2, Na+2O-2, O+2F-2, Pb+2O-2, Pb+4O-22, Pb+22Pb+4O-24, Na+2S+62O2-7, Na+2S+62O-26O-2, K+H+2P+5O-24, K+3P+5O-24, K+P+3H+O-23, Ca+2H-2, Al+3(O-2H+)Cl-2, Hg+2(N+5O-23)2, Ca+2(I+7O-24)2, Ca+2(I+5O-23)2, Ca+2(I+O-2)2, Ca+2Cl-(Cl+O-2).
-
Cr3+ катион хрома (III), Ca2+ катион кальция, Hg2+ катион ртути (II), S82+ катион октасеры (2+), H- гидрид-ион, Cl- хлорид-ион, O2- оксид-ион, N3- нитрид-ион, I3- трииодид(1-)-ион, S22- дисульфид(2-)-ион.
-
C22- - карбид(2-)-ион, ацетилинид-ион; N3- тринитрид(1-)-ион; O3- триоксид(1-), озонид-ион; O22- диоксид(2-)-ион, пероксид-ион; O2- диоксид(1-)-ион, надпероксид-ион.
-
CaH2 гидрид кальция, Al2O3 оксид алюминия, Fe2O3 оксид железа (III), Na2S сульфид натрия, SF6 фторид серы (VI), SeO2 оксид селена (IV), K3N нитрид калия, Mg3P2 фосфид магния, FeSe2 диселенид железа, Al2Cl6 гексахлорид диалюминия, SiC кабид кремния, Si3N4 нитрид кремния, S2I2 дифторид дисеры, OF2 фторид кислорода.
-
NaN3 тринитрид натрия, азид натрия; CaC2 дикарбид кальция, ацетилид кальция; K2O2 диоксид дикалия, пероексид калия; CsO2 диоксид цезия, надпероксид цезия; RbO3 триоксид рубидия, озонид рубидия.
-
HF фтороводорд, HI иодоводород, H2Se селеноводород, H2Te теллуроводород, As2H4 диарсин.
-
 K2O
оксид калия; BeO оксид
берилия; Tl2O3
триоксид диталия; оксид талия (III);
CO оксид углерода (II),
окись углерода; CO2
диоксид углерода, оксид углерода (II),
углекислый газ; GeO2
диоксид германия, оксид германия (IV);
N2O
оксид диазота, оксид азота (I),
закись азота; NO2
диоксид азота, оксид азота (IV);
N2O5
пентаоксид диазота, оксид азота (V);
Cr2O3
триоксид дихрома, оксид хрома (III);
Mn2O7
гептаоксид димарганца, оксид
марганца (VII).
K2O
оксид калия; BeO оксид
берилия; Tl2O3
триоксид диталия; оксид талия (III);
CO оксид углерода (II),
окись углерода; CO2
диоксид углерода, оксид углерода (II),
углекислый газ; GeO2
диоксид германия, оксид германия (IV);
N2O
оксид диазота, оксид азота (I),
закись азота; NO2
диоксид азота, оксид азота (IV);
N2O5
пентаоксид диазота, оксид азота (V);
Cr2O3
триоксид дихрома, оксид хрома (III);
Mn2O7
гептаоксид димарганца, оксид
марганца (VII). -
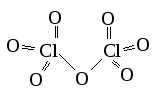
Оксиду марганца (VII) соответствует формула:
поскольку в оксидах между двумя атома марганца не может быть более одного мостикового атома кислорода.
27.
|
Формула |
Формула |
||
|
Молекулярная |
Структурная |
Молекулярная |
Структурная |
|
|
|
Al2O3 |
|
|
|
Mg=O |
PbO2 |
O=Pb=O |
|
As2O5 |
|
SO3 |
|
|
Cl2O7 |
|
OsO4 |
|

28.
29. К оксидам относится MnO2 и СrO3; Mn3O4 содержит по два мостиковых атома кислорода между атомами марганца и относится к солям; CrO5 содержит химическую связь между двумя атомами кислорода и относится к пероксидам.
30.
-
Оксид
Свойства
Реакции
Na2O
Основной
Na2O + H2O = 2NaOH
Na2O + 2HNO3 = 2NaNO3 + H2O
Na2O + SO3 = Na2SO4
Cl2O7
Кислотный
Cl2O7 + H2O = 2HClO4
Cl2O7 + 2KOH = 2KClO4 + H2O
Cl2O7 + CaO = Ca(ClO4)2
CrO
Основной
CrO + H2O = Cr(OH)2
CrO + 2HCl = CrCl2 + H2O
CrO + P2O5 = Cr(PO3)2
Cr2O3
Амфотерный
Cr2O3 + H2O
Cr2O3 + 2NaOH (расплав) = 2NaCrO2 + H2O
Cr2O3 + K2O (расплав) = KCrO2
Cr2O3 (расплав) + 3SO3 = Сr2(SO4)3
CrO3
Кислотный
CrO3 + H2O = H2CrO4
CrO3 + MgO = MgCrO4
CrO3 + 2NaOH = Na2CrO4 + H2O
31. LiOH гидроксид лития; Sr(OH)2 гидроксид стронция; Cu(OH) гидроксид меди (I); Cd(OH)2 гидроксид кадмия; Al(OH)3 гидроксид алюминия; Cr(OH)3 гидроксид хрома (III); CrO(OH) гидроксид-оксид хрома, метагидроксид хрома (III).
32.
-
Гидроксид
Формула
Молекулярная
Структурная
Гидроксид калия
KOH
K-O-H
Гидроксид берилия
Be(OH)2
H-O-Be-O-H
 Гидроксид
таллия (I)
Гидроксид
таллия (I)TlOH
Tl-O-H
Ортотогидроксид таллия (III)
Tl(OH)3
Метагидроксид железа (III)
FeO(OH)
O=Fe-O-H

Дигидроксид-оксид дижелеза
Fe2O(OH)2
33.
-
Гидроксид
Свойства
Реакции
Ba(OH)2
Основной
Ba(OH)2 + SO3 = BaSO4
Ba(OH)2 + 2HCl = BaCl2 + H2O
Zn(OH)2
Амфотерный
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Zn(OH)2 + 2NaOH (расплав) = Na2ZnO2 + 2H2O
Zn(OH)2 + K2O (расплав) = K2ZnO2
Zn(OH)2 + SO3 = ZnSO4 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Получение
Ba(OH)2
BaO + H2O = Ba(OH)2
BaCl2 + 2NaOH = Ba(OH)2 + 2NaCl
Zn(OH)2
ZnSO4 + 2NaOH = Na2 SO4 + Zn(OH)2
Na2[Zn(OH)4] + H2SO4 = Na2SO4 + Zn(OH)2 + 2H2O
Na2ZnO2 + H2SO4 = Na2SO4 + Zn(OH)2
34. H2SO4 серная, H2S2O7 дисерная, HNO3 азотная, HNO2 азотистая, H3PO4 ортофосфорная, HPO3 метафосфорная, H4P2O7 дифосфорная, H2PHO3 фосфористая (фосфоновая), HPH2O2 фосфорноватистая (фосфиновая), HСlO хлорноватистая, HClO2 хлористая, HClO3 хлорноватая, HClO4, хлорная, H5IO6 ортоиодная, HMnO4 марганцевая, H2Cr2O7 дихромовая.
35.
-
Кислота
Формула
Молекулярная
Структурная
Бромноватистая
HBrO
Br-O-H
Иодистая
HIO2
O=I-O-H
 Селенистая
СеленистаяH2SeO3

Ортотеллуровая
H6TeO6

Метамышьяковая
HasO3

Дикремниевая
H2Si2O5


Метаоловянная
H2SnO3

Фосфористая (фосфоновая)
H2PHO3

Фосфорноватистая (фосфиновая)
HPH2O2

Трифосфорная
H5P3O10
Метаванадиевая
HVO3
36.
-
Переход
Реакция
H3PO4HPO3
H3PO4 = HPO3 + H2O
H3PO4H4P2O7
2 H3PO4 = H4P2O7 + H2O
HPO3H4P2O7
2HPO3 + 2H2O = H4P2O7
H4P2O7H5P3O10
H4P2O7 + H3PO4 = H5P3O10 + H2O
H5P3O10H3PO4
H5P3O10 + 2H2O = 3H3PO4
37. Получение оксокислот - а) кислотный оксид + вода: SO3 + H2O = H2SO4; б) соль слабой кислоты + сильная кислота соль сильной кислоты + слабая кислота: Ba(ClO)2 + H2SO4 = BaSO4 + 2HclO.
38.
-
Пероксокислота
Название
Графическая формула
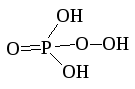
H3PO2(O2)
Пероксофосфорная


H4P2O6(O2)
Пероксодифосфорная
H3BO2(O2).
Пероксоборная
39. HSeO3F фтороселеновая кислота, HAsO2Cl2 дихлоромышьяковая кислота, H2CS3 тритиоугольная кислота, H3POS3 тиоортофосфорная кислота, H2AsO3(NH2) амидоортомышьяковистая кислота.
40.
-
Кислота
Формула
Молекулярная
Структурная


Тиосерная
H2S2O3
Тритионовая
H2S3O6
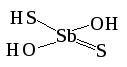
Дитиосурьмяная
H3SbO2S2
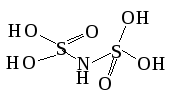
Иминосульфоновая
H2S2O4(NH)

Амидосульфоновая
H2SO3(NH2)

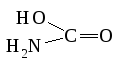
Дибромомышьяковая
HAsOBr2
Амидоугольная
HCO2(NH2)
41. HCl хлороводородная кислота, HBr бромоводородная кислота, HI иодоводородная кислота, H2S сероводородная кислота, H2Se селеноводородная кислота.
42.
-
Соединение
Название
Реакция с водой
Систематическое
Традиционное
SbOCl
Хлорид-оксид сурьмы
Хлорангидрил метасурьмяной кислоты
SbOCl + H2O = HSbO2 + HCl
SeO2F2
Дифторид-диоксид селена
Фторангидрид селеновой кислоты
SeO2F2 + 2H2O = H2SeO4 + 2HF
NOBr
Бромид-оксид азота
Бромангидрид азотистой кислоты
NOBr + H2O = HNO2 + HBr
NO2F
Фторид-диоксид азота
Фторангидрид азотной кислоты
NO2F+ H2O = HNO3 + HF
NF3
Фторид азота (III)
Трифторанигидрид ортоазотной кислоты
NF3 + 2H2O =
HNO3 + 3HF
AsOCl2F
Фторид-дихлорид-оксид мышьяка
Фтордихлорангидрид мышьяковой кислоты
AsOCl2F + 3H2O = H3AsO4 + 2HCl +HF
CO2Cl2
Дихлорид-диоксид углерода
Хлорангидрид угольной кислоты
CO2Cl2 + 2H2O = H2CO3 + 2HCl
SOCl2
Дихлорид-оксид серы
Хлорангидрид сернистой кислоты
SOCl2 + 2H2O = H2SO3 + 2HCl
SO2Br2
Дибромид-диоксид серы
Бромангидрид серной кислоты
SO2Br2 + 2H2O = H2SO4 + 2HBr
43.
-
Галогенангидрид
Формула
Молекулярная
Графическая
Хлорид-оксид бора
BOCl
O=B-Cl

Бромид кремния (IV)
SiBr4


Дифторид-оксид кремния
SiOF2
 Cульфурилфторид
CульфурилфторидSO2F2
Дихлорангидрид селенистой кислоты
SeOCl2
44.
-
Соль
Название
Соль
Название
FeSO4
Сульфат железа (II)
PbPbO3
Метаплюмбат свинца (II)
Fe2(S2O7)3
Дисульфат железа (III)
Pb2PbO4
Ортоплюмбат свинца (II)
CoSO3
Сульфит кобальта (II)
NaBO2
Метаборат натрия
K2TeO4
Метателлурат калия
Na2B4O7
Тетраборат натрия
Na6TeO6
Ортотеллурат натрия
K2ZnO2
Цинкат калия
Hg2(NO3)2
Нитрат ртути (I)
Na2CrO4
Хромат натрия
CsNO2
Нитрит цезия
K2Cr2O7
Бихромат калия
Cu3(PO4)2
Ортофосфат меди (II)
Fe2FeO4
Ортоферрит железа (II)
Mg2P4O7
Дифосфат магния
KMnO4
Перманганат калия
Sr(PO3)2
Метафосфат стронция
K2MnO4
Манганат калия
Соль
Название
Соль
Название
CaPHO3
Фосфит кальция
LiClO4
Перхлорат лития
LiPH2O2
Гипофосфит лития
NaClO3
Хлорат натрия
K2CO3
Карбонат калия
KClO2
Хлорит калия
BaGeO3
Германат бария
KСlO
Гипохлорит калия
45.
-
Соль
Название
Соль
Название
K2S2O8
Пероксодисульфат калия
KSeO2F
Фтороселенат калия
Na2S2O3
Тиосульфат натрия
K2SO3Se
Селеносульфат калия
Mg(SO3Cl)2
Хлорсульфонат магния
Na3PS4
Тиоортофосфат натрия
46.
-

Соединение
Формула
Молекулярная
Графическая
Пербромат калия
KBrO4


Ортопериодат натрия
Na5IO6

Метапериодат цезия
CsIO4

Иодат натрия
NaIO3
Хлорит кальция
Ca(ClO2)2
Гипобромит магния
Mg(BrO)2
Br-O-Mg-O-Br
Берилат натрия
Na2BeO2
Na-O-Be-O-Na

Ортодифосфат
железа(II)
Fe2P2O7

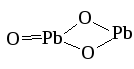
Дихромат аммония
(NH4)2Cr2O7
 Метаплюмбат
свинца(II)
Метаплюмбат
свинца(II)Pb(PbO3)
Ортоферрит железа(II)
Fe2FeO4
Метаарсенит цинка
Zn(AsO2)2
O=As-O-Zn-O-As=O


Фторсульфонат натрия
NaSO3F
Тритиокарбонат бария
BaCS3

Тиоортофосфат калия
K3PS4
47. Na2H2P2O7 дигидродифосфат натрия, NaH2PO4 дигидрофосфат натрия, Na2HPO4 гидрофосфат натрия, Ca(HSO3)2 гидросульфит кальция, Na2H3IO6 тригидропериодат натрия, [Al(OH)2]SO4 дигидроксосульфат алюминия, Fe(OH)NO2 гидроксонитрит железа (II), (CuOH)2CO3 гидроксокарбонат меди.
48.
-
Соль
Формула
Молекулярная
Графическая


Дигидроарсенат хрома(III)
Cr(H2AsO4)3

Гидросульфат
Железа(III)
Fe(HSO4)3
Нитрит
гидроксоалюминия
Al(OH)(NO3)2

Фосфит
Гидроксомагния
[Mg(OH)]2(PHO3)
49.
-
 Соль
СольТрадиционное название
Графическая формула

UO2(NO3)2
Нитрат-диоксид урана
(BiO)2SO4
Сульфат-оксид висмута
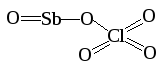
SbOClO4
Перхлорат оксид-сурьмы
50.
-
Соль
Традиционное название
Графическая формула

KAl(SO4)2
Сульфат алюминия-калия
Ca(ClO)Cl
Хлорид-гипохлорит кальция
Cl-Ca-O-Cl
51. CuSO45H2O – пентагидрат сульфата меди (II), Na2B4O710H2O – декагидрат тетрабората натрия, (UO2)3(AsO4)212H2O - додекагидрат ортоарсенат-диоксида урана.
52.
-
Соль
Традиционное название
Графическая формула
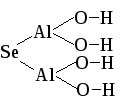 Fe(HS)2
Fe(HS)2Гидросульфид железа (II)
H-S-Fe-S-H
[Al(OH)2]2Se
Селенид дигидроксоалюминия
Mg(OH)CN
Цианид гидроксомагния
H-O-Mg-CN
AsOCl
Хлорид-оксид мышьяка
O=As-Cl
53. 1) Mg(OH)2 + H2CO3 = MgCO3 + 2H2O, Mg(OH)2 + 2H2CO3 = Mg(HCO3)2 + 2H2O,
2Mg(OH)2 + H2CO3 = (MgOH)2CO3 + 2H2O; 2) Al(OH)3 + H3PO4 = AlPO4 + 3H2O, 2Al(OH)3 + 3H3PO4 = Al2(HPO4)3 + 6H2O, Al(OH)3 + 3H3PO4 = Al(H2PO4)3 + 3H2O, 3Al(OH)3+2H3PO4=(AlOH)3(PO4)2+6H2O, 3Al(OH)3+H3PO4=[Al(OH)2]3(PO4)+ 6H2O
54.
-
Комплекс
Коорд. Центр
Лиганды
Комплекс
Коорд. центр
Лиганды
ЭZ
К.Ч.
ЭZ
К.Ч.
SF6
S+6
6
F-
SO3
S+6
3
O-2
SO2Cl2
S+6
4
O-2, Cl-
SO2
S+4
2
O-2
[SO3]2-
S+4
3
O-2
[SO4]2-
S+6
4
O-2
[CrO4]2-
Cr+6
4
O-2
[UO2]2+
U+6
2
O-2
[ZnO2]2-
Zn+2
2
O2-
[NH4]+
N-3
4
H+
[NO2]-
N+3
2
O-2
[NO3]-
N+5
3
O-2
[Mn(H2O)6]2+
Mn+2
6
H2O
[NiCl4]2-
Ni+2
4
Cl-
Ni(CO)4
Ni0
4
CO
[Ni(CN)4]2-
Ni+2
4
CN-
[Co(NH3)6]3+
Co+3
6
NH3
[Al(OH)6]3-
Al+3
6
OH-
55.
|
Комплекс |
Сфера |
Комплекс |
Сфера |
|||
|
Внеш. |
Внутр. |
Внеш. |
Внутр. |
|||
|
Na2SO4 |
Na+ |
[SO4]2- |
K2Cr2O7 |
K+ |
[Cr2O7]2- |
|
|
Ba2[Fe(CN)6] |
Ba2+ |
[Fe(CN)6]4- |
Rb[B(OH)4] |
Rb+ |
[B(OH)4]- |
|
|
H3PO4 |
H+ |
[PO4]3- |
[UO2]Cl2 |
Cl- |
[UO2]2+ |
|
|
[Co(NH3)5Cl]Cl2 |
Cl- |
[Co(NH3)5Cl]2+ |
NH4NO3 |
- |
[NH4]+, [NO3]- |
|
|
Комплекс |
Внутренняя сфера |
|||||
|
[Cr(H2O)6][Cr(CN)6] |
[Cr(H2O)6]3+, [Cr(CN)6]3- |
|||||
Внешняя сфера – преимущественно ионный, внутрення сфера – ионно-ковалентный характер химической связи.
56.
|
Комплекс |
Лиганд (дентатность) |
Комплекс |
Лиганд (дентатность) |
|
Na[Co(NH3)4(CO3)2] |
NH3 (1), СО32- (1) |
[Co(NH3)4CO3]ClO4 |
NH3 (1), СО32- (2) |
|
Na[CoEn2(CO3)2] |
En (2), СО32- (1) |
Na[Co(ЭДТА)] |
ЭДТА4- (6) |
|
Na[Co(ЭДТА)Сl2] |
ЭДТА4- (4), Cl- (1) |
|
|
Дентатность – число координационных мест, занимаемых во внутренней сфере комплекса лигандом.
57. N3-, CN-, NCS-, N2H4, NCO-.
58. Моноядерные – комплексы с одним координационным центром: [NiCl4]2-; полиядерные – комплексы с несколькими координационными центрами, объединенными мостиковыми лигандами: [Co(NH3)5(-CN)Cr(NH3)5]5+; хелатные – комплексы с полидентатными хелатирующими (циклообразующими) лигандами: [CuEn2]2+; внутрикомплексные соединения – комплексы с полидентаными лигандами, характеризующихся образованием с центральным ионом-комплексообразователем двух типов химических связей – одну по обменному механизму и одну по донорно-акцепторному механизму: [NiDMG2].
59. 2,2’-бипиридил потенциально хелатирующий лиганд, а 4,4’-бипиридил – потенциально мостиковый лиганд.
60.
-
Комплекс
Тип
Na[PF6]
Моноядерный, анионный, ацидокомплекс
SO3
Моноядерный, нейтральный оксокомплекс
SO2Cl2
Моноядерный, нейтральный, смешанно-лигандный, оксо-ацидо-комплекс
SO2
Моноядерный, нейтральный, оксокомплекс
Na2[SO3]
Моноядерный, анионный, оксокомплекс
Na2[S2O7]
Биядерный с мостиковым кислородным лигандом, анионный, оксокомплекс
H2[CrO4]
Биядерный с мостиковым кислородным лигандом, анионный, оксокомплекс
[UO2](NO3)2
Моноядерный, катионный, оксокомплекс
K2[ZnO2]
Моноядерный, анионный, оксокомплекс
Ba[Al(OH)4]2
Моноядерный, анионный, гидроксокомплекс
[NH4]Cl
Моноядерный, катионный комплекс
[Mn(H2O)6]SO4
Моноядерный, катионный, аквакомплекс
[Cr(H2O)3Cl3]
Моноядерный, нейтральный, смешанно-лигандный аква-ацидо-комплекс
K2[NiCl4]
Моноядерный анионный, ацидокомплекс
Ni(CO)4
Моноядерный, нейтральный, карбонильный комплекс
Na2[Ni(CN)4]
Моноядерный, анионный, ацидокомплекс
[Co(NH3)4CO3]2(SO4)
Моноядерный, катионный, смешанно-лигандный, амино-ацидный комплекс
[Pt(NH3)4][PdCl4]
Моноядерный, катионно-анионный, амино-ацидный комплекс
61.
-
Изомеры
Пример
Геометрические
Транс-[Pd(NH3)2Cl2] и цис-[Pd(NH3)2Cl2];
транс-K3[Fe(CN)4Cl2] и цис- K3[Fe(CN)4Cl2]
Связевые
[Co(NH5)CN]Cl2 и [Co(NH5)NC]Cl2; [Pt(NH3)5NCS](NO3)3 и [Pt(NH3)5SCN](NO3)3
Гидратные
[Co(NH3)4(Н2O)2]Cl3 и [Co(NH3)4(Н2O)Cl]Cl2H2O;
[Co(NH3)4(Н2O)Cl]Cl2H2O и [Co(NH3)4Cl2]Cl22H2O
Ионизационные
[Cr(NH3)5CO3]SO4 и [Cr(NH3)5SO4]CO3;
[Pt(NH3)3Cl]NO3 и [Pt(NH3)3(NO3)]Cl
Координационные
[Pt(NH3)4][Pd(CN)4] и [Pd(NH3)4][Pt(CN)4];
[CrEn3][Fe(CN)6] и [FeEn3][Cr(CN)6]
62.
-
Лиганд
Название
Лиганд
Название
Лиганд
Название
H-
Гидридо-
Cl-
Хлоро-
S2-
Сульфидо- (тио-)
OH-
Гидроксо-
CN-
Циано-
N3-
Азидо-
NCS-
Тиоцианато- (родано-)
NO2-
Нитро-
SO42-
Сульфато-
H2O
Аква-
NH3
Аммин
CO
Каврбонил
NO
Нитрозил
N2
Диазот
PPh3
Трифенилфосфин
En
Этилендиамин
Edta
Этилендиаминтетраацетато-
63.
-
Комплекс
Систематическое название
K2MnO4
Тетраоксоманганат(VII) калия
H2SO4
Тетраоксосульфат(VI) водорода
HSO3Cl
Триоксохлоросульфат(VI) водорода
Na[B(OH)4]
Тетрагидроксоборат натрия
Ca[Fe(CN)6],
Гексацианоферрат(II) кальция
(NH4)2[HgI4]
Тетраиодомеркурат(II) аммония
H[AuCl4]
Тетрахлороаурат(III) водорода
Al[Cr(NCS)6]
Гексатиоцианатохромат(III) алюминия
Na[PtCl(OH)5]
Пентагидроксохлороплатинат(IV) натрия
[Ag(NH3)2]Cl
Хлорид диамминсеребра
[CuEn2](NO3)2
Нитрат бисэтилендиаминмеди(II)
[Zn(H2O)4]ClO4
Перхлорат тетрааквацинка
[Rh(NH3)4CO3]NO3
Нитрат карбонатотетрамминродия(III)
[Co(NH3)5NO2]Cl2
Хлорид нитропентаамминкобальта(III)
[Co(NH3)5(ONO)]Cl2
Хлорид нитритопентаамминкобальта(III)
[Pt(NH3)2Cl2]
Дихлородиамминплатина
[Cr(H2O)3С2O4Cl]
Хлорооксалатотраквахром
Ni(CO)4
Тетракарбонилникель
[Pt(PPh3)4]
Трифенилфосфинплатина
[Co(NH3)6][Co(CN)6]
Гексацианокобальтат(III) гексаамминхрома(III)
[PtEn2][Pd(NH3)Cl3]2
Трихлороамминпалладат(II) бисэтилендиаминплатины(II)
64.
-
Комплекс
Формула
Гексафторофосфат(V) натрия
Na[PF6]
Тетраоксоманганат(VI) калия
K[MnO4]
Тетрагидроксоцинкат магния
Mg[Zn(OH)4]
Тринитродихлороакваирридат(III) калия
K[Ir(H2O)Cl2(NO2)3]
Цис-тетраиододиамминплатина
Цис-[Pt(NH3)2I4]
Трироданотриаквахром
[Cr(H2O)3(NCS)3]
Сульфитодиамминпалладий
[Pd(NH3)2(SO3)2]
Нитрат транс-бисэтилендиаминдихлорокобальта(III)
Транс-[CoEn2Cl2]NO3
Гексафторохромат(III) гексааквахрома(III)
[Cr(H2O)6][CrF6]
Тетрацианоплатинат(II) тераамминпалладия(II)
[Pd(NH3)4][Pt(CN)4]
65.
-
Комплекс
Название
K2Mo2O7
(оксо)-бис[триоксомолибдат(VI)] калия
Na2B2O7
(оксо)-бис(триоксоборат) натрия
Na2S2O8,
(пероксо)-бис[триоксосульфат(VI)] натрия
[Cl2Pt(N2H4)PtCl2]
(гидразин)-бис(дихлороплатина)
K2[Cl4Re-ReCl4]
Бис[тетрахлороренат(III)] (Re-Re)
[Cl2(NH3)3CoNH2Co(H2O)(NH3)Cl]Cl2
Хлорид (-имидо)[хлороамминаквакобальта(III)-дихлоротриамминкобальта(III)]

Три(-хлоро)-бис[трихлоровольфрамат(VI)] (W-W) калия
66. TiO1+x – оксид титана (II) (избыток кислорода), TiO1-х – оксид титана (II) (недостаток кислорода), 6Ar46H2O – аргон-вода (6/46), CH4nH2O – метан-вода (1/n), WF64NH3 – гексафторид вольфрама-аммиак (1/4).
67. CO, Cl2, H2S, NO, NO2, HCl, NH3.
68. Кислоту к воде, так как в результате выделения тепла при разбавлении концентрированных кислот возможно разбрызгивание.
69. Под тягой.
70. Нейтрализация кислоты раствором соды, а основания разбавленным раствором борной кислоты. Засыпать место разлива песком, собрать его и промыть место разлива водой.
71. 7.0610-26 кг.
72. 3.72 мл, 1.1810-5 кг.
73. 9863.
74. 9,110-32 кг
75. 8.18 моль
76. Р(N2)P(O2) = 1.143, баллон с кислородом следует нагреть до Т = 325.7 К.
77. 0.237 кг
78. 8.47510-3 кг
79. m(над H2O)m(над Hg) = 99101.3.
80. Br2.
81. O3.
82. Cu(NO3)221H2O.
83. Si.
84. C2H4O2.
85. B2H6.
86. N2H4.
87. (HF)2, HF.

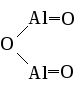
 Rb2O
Rb2O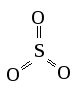 MgO
MgO