
- •Глава 11 Блохин а.В.
- •Глава 11 химическое равновесие (термодинамика систем с химическими реакциями)
- •11.1. Общие положения и понятия
- •11.2. Общие условия химического равновесия.
- •11.3. Химическое равновесие в смесях идеальных газов. Константа равновесия.
- •11.4. Изобарно-изотермический потенциал (энергия Гиббса) химической реакции. Уравнение изотермы химической реакции
- •11.5. Химические равновесия в растворах
- •11.6. Гетерогенные химические равновесия
- •11.7. Смещение равновесия. Принцип Ле-Шателье – Брауна
- •11.8. Зависимость константы равновесия от температуры. Уравнения изобары и изохоры Вант-Гоффа
- •11.9. Влияние давления на химическое равновесие
- •11.10. Вычисление стандартной энергии Гиббса и констант равновесия химических реакций по таблицам термодинамических величин
- •11.11. Вычисление стандартной энергии Гиббса и константы равновесия химической реакции по методу Темкина – Шварцмана
- •11.12. Вычисление стандартной энергии Гиббса и константы равновесия химической реакции с помощью функции приведенной энергии Гиббса
- •11.13. Расчет константы равновесия методом комбинирования реакций
- •11.14. Вычисление равновесного состава реакций, протекающих в идеально-газовой системе
- •11.15. Химическое равновесие и тепловой закон Нернста
11.8. Зависимость константы равновесия от температуры. Уравнения изобары и изохоры Вант-Гоффа
Качественно зависимость константы равновесия от температуры определяется принципом Ле-Шателье – Брауна. Найдем количественную зависимость константы равновесия от температуры. Стандартная энергия Гиббса реакции равна
![]() ,
,
поэтому
![]() . (11.42)
. (11.42)
После подстановки соотношения (11.42) в уравнение Гиббса – Гельмгольца и преобразований полученного выражения получаем:
![]() , (11.43)
, (11.43)
![]() ,
,
![]() . (11.44)
. (11.44)
Уравнение (11.44), справедливое для реакций, протекающих при постоянном давлении, называют уравнением изобары Вант-Гоффа или уравнением изобары химической реакции Знак производной в уравнении (11.44) определяется знаком теплового эффекта реакции:
если
![]() ,
то
,
то
![]() ,
,
значит, с повышением температуры константа равновесия увеличивается и химическое равновесие смещается в сторону образования продуктов;
если
![]() ,
то
,
то
![]() ,
,
следовательно, с ростом температуры константа равновесия уменьшается и равновесие смещается в сторону образования исходных веществ;
если
![]() ,
то константа равновесия не зависит от
температуры.
,
то константа равновесия не зависит от
температуры.
Зависимость стандартной константы равновесия от температуры при постоянном давлении представлена на рис. 11.1.
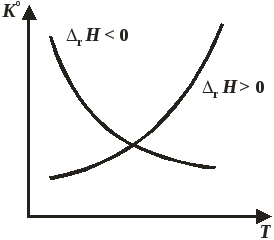
Рис. 11.1. Зависимость константы равновесия от температуры
По аналогии можно получить уравнение
![]() , (11.45)
, (11.45)
которое называют уравнением изохоры Вант-Гоффа или уравнением изохоры химической реакции (справедливо для реакций, протекающих при постоянном объеме).
Разделим переменные и проинтегрируем уравнение изобары Вант-Гоффа (11.44). Для небольшого интервала температур можно принять, что энтальпия реакция не зависит от температуры, тогда
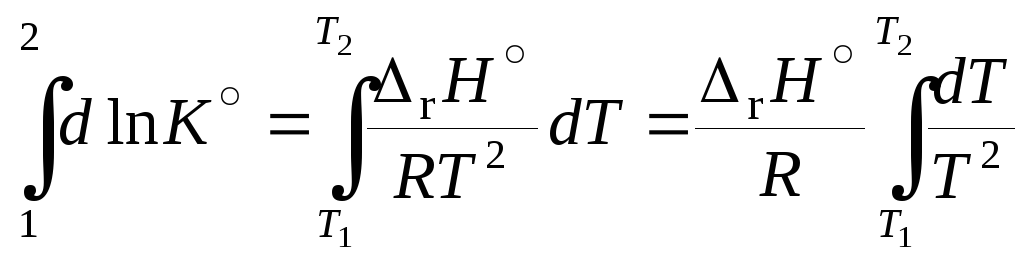 ,
,
![]() . (11.46)
. (11.46)
По уравнению (11.46) можно определить тепловой эффект реакции на основании двух значений констант равновесия при различных температурах, хотя чаще по этому уравнению определяют константу равновесия при заданной температуре.
При неопределенном интегрировании уравнения (11.44) получаем линейное уравнение
![]() , (11.47)
, (11.47)
где А
– константа интегрирования,
![]() .
.
Линейная зависимость логарифма константы равновесия от обратной температуры (рис. 11. 2) служит подтверждением независимости теплового эффекта реакции от температуры в данном температурном интервале. Таким образом, энтальпия реакции может быть определена по уравнению изобары Вант-Гоффа без калориметрических измерений.
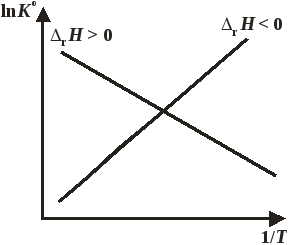
Рис. 11.2. Зависимость lnK° от обратной температуры.
11.9. Влияние давления на химическое равновесие
Для реакций с идеальными газами стандартная константа равновесия является функцией только температуры и не зависит от давления:
![]() . (11.48)
. (11.48)
Однако это не означает, что при изменении общего давления количество веществ, находящихся в равновесии, обязательно не изменится. Найдем аналитическую зависимость константы равновесия Ky от давления. Согласно уравнению (11.20)
![]() .
.
Преобразуем это выражение:
![]() ,
,
![]() .
.
Поскольку стандартное давление не зависит от давления в системе, то
![]() .
.
Следовательно,
![]() ,
,
![]() (11.49)
(11.49)
Полученное уравнение называют уравнением Планка – Ван-Лаара.
Общее давление в системе всегда положительно, поэтому
![]() ,
если
,
если
![]() ,
,
т. е. константа равновесия Ky и выход продуктов реакции будут увеличиваться с ростом давления для реакций, протекающих с уменьшением числа молей газообразных веществ, и наоборот.
Для реакций с идеальными газами при постоянных давлении и температуре
![]() ,
,
тогда
![]() . (11.50)
. (11.50)
где ΔrV – изменение объема системы при протекании реакции. Итак,
![]() ,
если
,
если
![]() .
.
Выход продуктов увеличивается с повышением давления для реакций, при протекании которых объем системы уменьшается.
Согласно уравнениям (11.49) и (11.50) для идеально-газовой реакции, в ходе которой число молей веществ не изменяется (Δν = 0), давление не влияет на состав равновесной смеси.
Рассмотрим вопрос о том, как влияет введение инертного идеального газа в систему на состав равновесной смеси при постоянной температуре. Если инертный газ вводится при постоянном объеме, то состав равновесной смеси не изменится, так как останутся постоянными равновесные парциальные давления участников реакции.
Если инертный газ вводится при постоянном давлении, то общее давление газов, участвующих в реакции, уменьшится. Тогда, согласно уравнению Планка – Ван-Лаара, если реакция протекает с увеличением числа молей, то константа равновесия и выход продуктов реакции увеличиваются:
если
![]() ,
то
,
то
![]() ;
тогда
;
тогда
![]() при
при
![]() .
.
И наоборот:
если
![]() ,
то
,
то
![]() ;
тогда
;
тогда
![]() при
при
![]() .
.
Наконец, если число молей газов в ходе реакции не изменяется, то введение инертного газа не оказывает влияния на состав равновесной смеси.
Для реакций с веществами в конденсированном состоянии изменение объема незначительно и давление, как правило, мало влияет на состояние химического равновесия.
