
- •Глава 8 Блохин а.В.
- •Глава 8 термодинамика жидких растворов
- •8.1. Давление насыщенного пара растворителя над раствором. Закон Рауля.
- •8.2. Давление насыщенного пара растворенного вещества над раствором. Закон Генри.
- •8.3. Состав насыщенного пара идеального жидкого раствора.
- •8.4. Диаграммы равновесия «жидкость – пар» идеальных бинарных растворов. Правило рычага.
- •8.5. Температура кипения идеального раствора. Диаграмма состояния «температура кипения – состав».
- •8.6. Термодинамическое обоснование разделения жидкостей перегонкой.
- •8.7. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля.
- •8.8. Законы Гиббса-Коновалова.
- •8.9. Химический потенциал компонента в идеальном и предельно разбавленном жидком растворе.
- •8.10. Химический потенциал компонента в реальном растворе. Активность.
- •8.11. Избыточные термодинамические функции. Термодинамическая классификация растворов.
- •8.12. Растворимость газов в жидкостях.
- •8.13. Равновесия «жидкость – жидкость» и «пар – жидкий раствор» в системах с ограниченной взаимной растворимостью жидкостей.
- •8.13.1. Равновесие «жидкость – жидкость» в системах с ограниченной взаимной растворимостью жидкостей.
- •8.13.2. Равновесие «пар – жидкий раствор» в системах с ограниченной взаимной растворимостью жидкостей.
- •8.14. Равновесие «пар – жидкость» в системах с взаимно нерастворимыми жидкостями.
8.5. Температура кипения идеального раствора. Диаграмма состояния «температура кипения – состав».
Под температурой кипения раствора понимают температуру, при которой общее давление насыщенного пара над раствором становится равным внешнему давлению. Если раствор идеальный, то при постоянном внешнем давлении Pвн = const справедливо:
![]() . (8.28)
. (8.28)
Для небольших температурных интервалов (согласно уравнению (5.20), глава 5) температурные зависимости давлений насыщенного пара чистых компонентов можно представить в виде следующих уравнений:
![]() ,
,
![]() .
.
Таким образом, во-первых, при постоянном внешнем давлении отсутствует линейная зависимость между составом раствора (х2) и температурой кипения раствора (T). Во-вторых, для расчета температуры кипения раствора необходимо знать свойства чистых компонентов – константы уравнения Клапейрона-Клаузиуса А1, А2, В1 и В2.
Тем не менее, диаграмму состояния идеального бинарного раствора «температура кипения – состав» можно построить для заданного внешнего давления, поскольку
![]() ,
,
![]() ,
,
![]() , (8.29)
, (8.29)
![]() . (8.30)
. (8.30)
Зависимость температуры кипения идеального бинарного раствора от состава раствора и пара представлена на рис. 8.4.
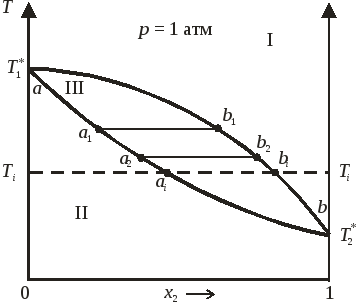
Рис. 8.4. Диаграмма состояния «температура кипения – состав»
идеального бинарного раствора.
В области I диаграммы
существует только пар (газовый раствор),
в области II — только жидкий раствор;
область III является областью сосуществования
пара и жидкого раствора. Нижняя кривая
aa1a2…b
называется кривой
кипения;
верхняя кривая ab1b2…b
— кривой
конденсации;
![]() и
и
![]() — температуры кипения чистых жидкостей
(компонентов).
— температуры кипения чистых жидкостей
(компонентов).
Для случая, представленного на рис. 8.4, температура кипения второго компонента меньше температуры кипения первого компонента, поэтому второй компонент является более летучим (то есть при заданной температуре давление насыщенного пара второго чистого компонента выше по сравнению с первым компонентом). В области III состав жидкой и паровой фаз при любой температуре определяется пересечением изотермы Ti = const с кривыми кипения и конденсации (точки ai и bi для жидкого раствора и насыщенного пара соответственно), а соотношение между количествами фаз, сосуществующих в равновесии, подчиняется правилу рычага (рис. 8.5).
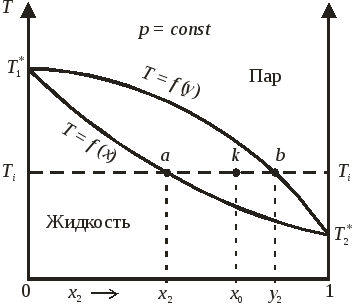
Рис. 8.5. Правило рычага в применении к диаграмме состояния
«температура кипения – раствор».
8.6. Термодинамическое обоснование разделения жидкостей перегонкой.
Тот факт, что даже в случае идеального раствора составы жидкой и паровой фаз не одинаковы, позволяет разделить компоненты раствора путем перегонки. Различают простую и фракционную перегонку. Простая перегонка заключается в однократном проведении цикла «испарение – конденсация», фракционная – в последовательном проведении нескольких подобных циклов. Непрерывная фракционная перегонка называется ректификацией.
Эффективность перегонки зависит, очевидно, от величины различия составов жидкости и пара (от разности y2 – x2). Мольная доля растворенного вещества в паре в соответствии с уравнением (8.20) равна
![]() .
.
Тогда
![]() ,
,
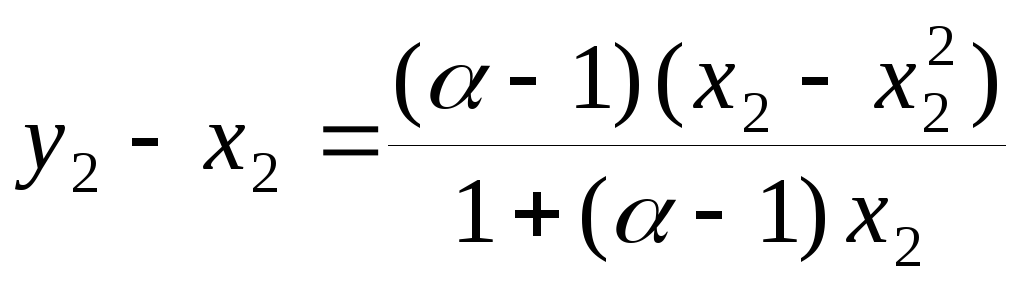 . (8.31)
. (8.31)
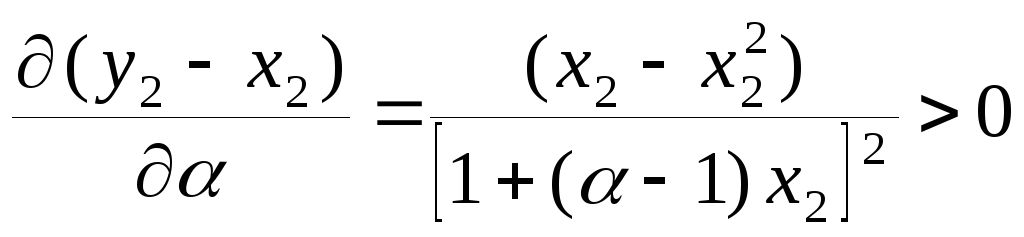 . (8.32)
. (8.32)
Итак, чем больше величина относительной летучести компонентов, тем больше отличаются составы жидкой и паровой фаз и тем эффективнее перегонка. Примем, что второй компонент более летуч, следовательно,
![]() .
.
По уравнению Клапейрона-Клаузиуса
![]() и
и
![]() .
.
Тогда
![]() ,
,
![]() ,
,
![]() . (8.33)
. (8.33)
Поскольку
![]() ,
то нормальная температура кипения
чистого первого компонента выше, чем
второго:
,
то нормальная температура кипения
чистого первого компонента выше, чем
второго:
![]() .
.
По правилу Трутона
![]() ,
,
следовательно, и энтальпия испарения первого компонента больше, чем второго:
![]() .
.
Окончательно получаем:
![]() . (8.34)
. (8.34)
Относительная летучесть компонентов будет увеличиваться при понижении температуры.
Таким образом, чем ниже температура, тем больше относительная летучесть компонентов и тем больше различаются составы жидкой и паровой фаз (и тем эффективнее перегонка). Поэтому для эффективного разделения компонентов перегонку их раствора следует проводить при возможно более низких температурах (соответственно при пониженном внешнем давлении).
