
- •Глава 2 Блохин а.В.
- •Глава 2. Первый закон (первое начало) термодинамики. Термохимия.
- •2.1. Внутренняя энергия системы. Работа и теплота.
- •2.2. Первый закон термодинамики.
- •2.3. Виды работы, потерянная работа.
- •2.4. Работа расширения идеальных газов в различных обратимых и необратимых процессах.
- •2.5. Калорические коэффициенты. Энтальпия.
- •2.6. Теплоемкость.
- •2.7. Уравнение адиабаты идеального газа.
- •2.8. Политропные процессы.
- •2.9. Термохимия. Закон Гесса. Термохимические уравнения.
- •2.10. Стандартное состояние и стандартные условия. Следствия из закона Гесса.
- •2.11. Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа.
- •2.12. Теплоемкость газов, жидкостей и кристаллических тел.
2.6. Теплоемкость.
Отношение количества теплоты δQ, полученной веществом при бесконечно малом изменении его состояния в каком-либо процессе, к изменению температуры dT вещества называется теплоемкостью (символ С, единица Дж/К):
![]() .
.
Теплоемкость системы – экстенсивная величина. Теплоемкость, отнесенная к единице массы или количества вещества, становится интенсивным параметром. Теплоемкость единицы массы (кг, г) называется удельной (единица Дж/(кг К) и Дж/(г К)), а теплоемкость 1 моль вещества – молярной теплоемкостью (единица Дж/(моль К)).
Различают истинную С = δQ/dT и среднюю теплоемкость
![]() .
.
Средняя и истинная теплоемкости связаны соотношением
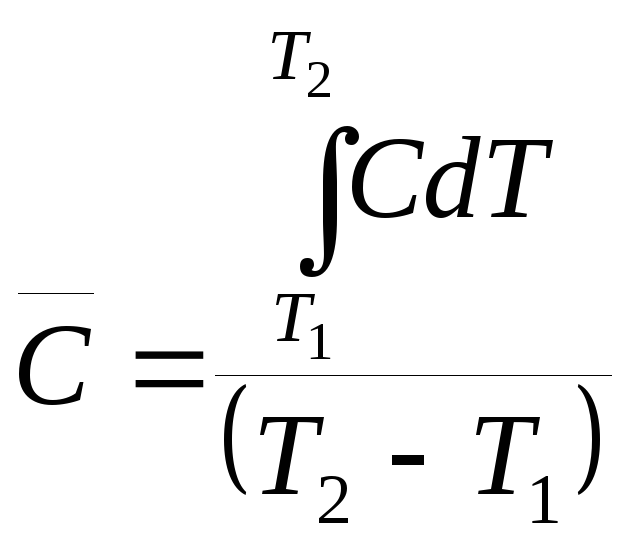 (2.37)
(2.37)
Количество теплоты, поглощенное телом при изменении его состояния, зависит не только от начального и конечного состояния тела (в частности, от температуры), но и от условий перехода между этими состояниями. Следовательно, от условий нагревания тела зависит и его теплоемкость.
Поэтому:
В изотермическом процессе (Т = const):
![]() ;
;
(при подводе теплоты
![]() и
и
![]() ,
и наоборот)
,
и наоборот)
В адиабатическом процессе (δQ = 0):
![]()
На практике используют теплоемкость при постоянном объеме – изохорную теплоемкость СV и теплоемкость при постоянном давлении – изобарную теплоемкость СР, если процесс проводят при постоянном объеме или при постоянном давлении.
При V = const (изохорный процесс):
![]() . (2.38)
. (2.38)
При Р = const (изобарный процесс)
![]() . (2.39)
. (2.39)
Следует помнить, что δQ можно приравнять к dU, если система может выполнять только работу расширения.
При V = const согласно (2.38) можно записать
![]() .
.
Таким образом, количество теплоты, необходимое для нагревания 1 моль и n моль вещества от температуры Т1 до температуры Т2 при постоянном объеме, можно рассчитать по формулам:
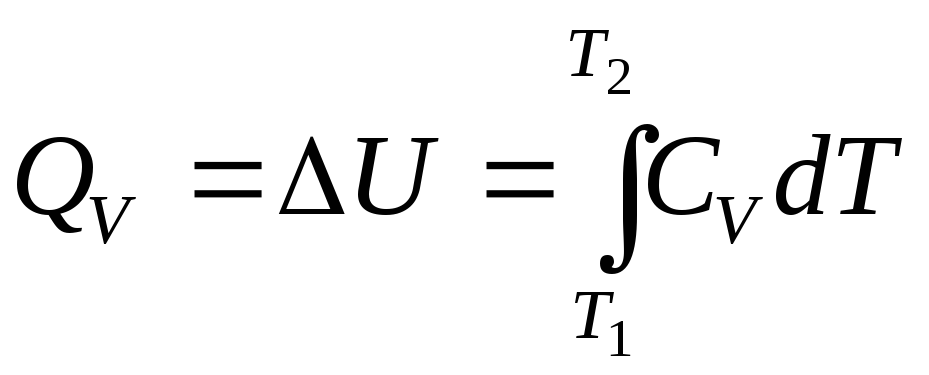 и
и
 . (2.40)
. (2.40)
Если СV = const (идеальный газ), то
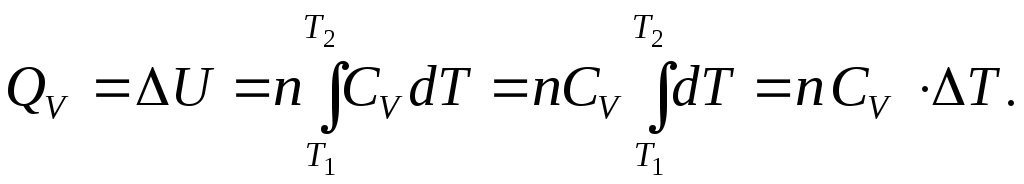
Аналогичным образом, если процесс протекает при P = const , то согласно (2.39) справедливо
![]() .
.
Количество теплоты, необходимое для нагревания 1 моль и n моль вещества от температуры Т1 до температуры Т2 при постоянном давлении, можно рассчитать по формулам:
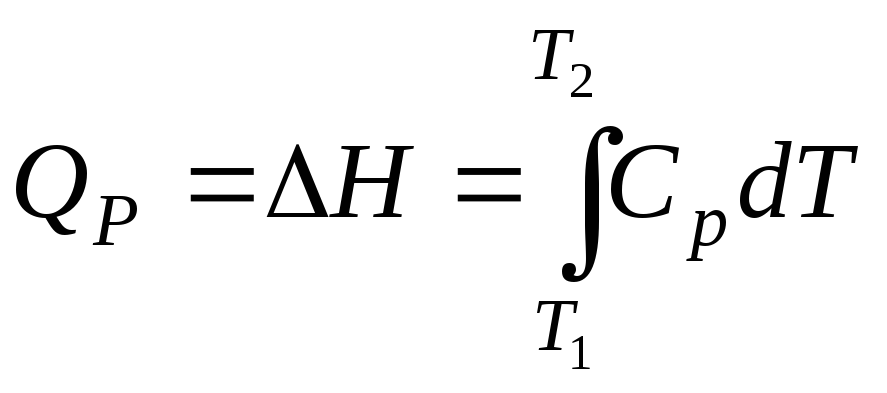 и
и
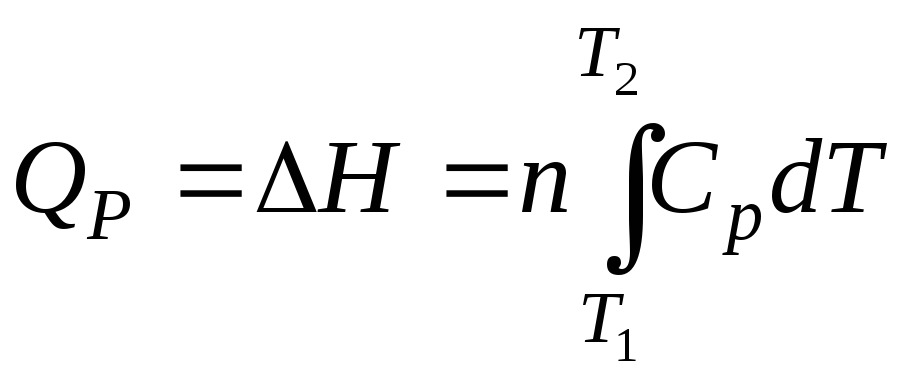 . (2.41)
. (2.41)
Если СP = const (идеальный газ), то
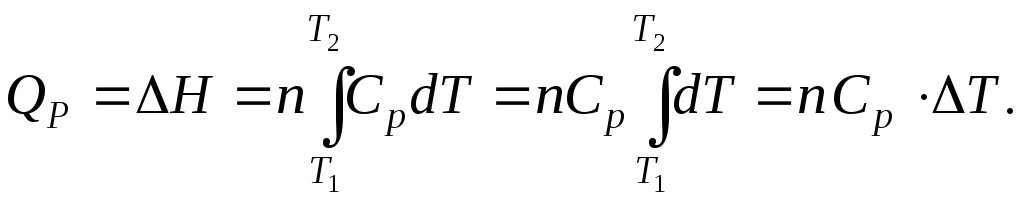
Теплоемкость при постоянном давлении Ср больше, чем теплоемкость при постоянном объеме СV (кроме некоторых веществ с аномальным изменением объема с температурой: например, для жидкой воды при 4 оС СР = СV). При нагревании при постоянном давлении часть теплоты идет на производство работы расширения, а часть на увеличение внутренней энергии тела; при нагревании же при постоянном объеме вся теплота расходуется на увеличение внутренней энергии. Так, при повышении температуры 1 моль идеального газа на 1 К при постоянном давлении выполняется работа расширения
![]() .
.
Следовательно, разность теплоемкостей СР и СV идеального газа равна
![]() . (2.42)
. (2.42)
Последнее соотношение известно как уравнение Майера.
Найдем связь между Сp и СV для любых систем, которые могут совершать только работу расширения. Согласно первому закону термодинамики
![]() .
.
Внутренняя энергия
является функцией внешних параметров
и температуры. Для простой системы
![]() ,
тогда
,
тогда
![]() ,
,
![]() ,
,
![]() . (2.43)
. (2.43)
Величина dV/dT (изменение объема с изменением температуры) представляет собой отношение приращений независимых переменных, то есть величина неопределенная, если не указать характер процесса, при котором происходит теплообмен.
Если процесс изохорный (V = const), то dV = 0, dV/dT = 0 и
![]() . (2.44)
. (2.44)
Если процесс изобарный (P = const), то
![]() . (2.45)
. (2.45)
Следовательно, для любых простых систем справедливо:
![]() . (2.46)
. (2.46)
Выражение справа является величиной положительной и, таким образом, изобарная теплоемкость всегда больше изохорной:
![]() .
.
Для идеальных газов выполняется закон Джоуля (внутренняя энергия идеального газа зависит только от температуры – строго докажем при рассмотрении второго закона термодинамики):
![]() .
.
Поскольку для 1 моля идеального газа РV = RT, то
![]() ,
,
![]() (уравнение Майера).
(уравнение Майера).
Для реальных газов
![]() ;
;
причем чем выше давление газа, тем больше будет разность теплоемкостей отличаться от R.
С повышением температуры разность теплоемкостей для реальных газов, жидкостей и твердых тел (Сp – СV) увеличивается, а при Т → 0 К эта разность, как и сами теплоемкости Сp и СV, стремятся к нулю. Для кристаллических тел при обычной температуре (300 К) разность (Сp – СV) < R и составляет величину порядка 1 – 2 Дж/(моль К), а при температурах плавления Сp/CV ≈ 1,25. Для жидкостей различие Сp и СV больше, чем для твердых тел, и зависит от природы жидкостей.
