
- •1.Основные законы и понятия в химии.
- •2.Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
- •3. Основания (кислотность оснований). Методы получения, хим. Св-ва, номенклатура.
- •4. Кислоты (основность кислот). Методы получения, хим. Св-ва, номенклатура.
- •5. Соли, типы солей. Методы получения, химические св-ва, номенклатура средних, кислых, основных солей.
- •6. Квантово-механическая модель атома: уравнение де Бройля и Шредингера, принцип неопределённости Гейзенберга, атомная орбиталь, квантовые числа.
- •7. Правила заполнения электронами атомных орбиталей (принцип минимальной энергии, правило Клечковского, правила Паули и Гунда.)
- •8. Периодический закон Менделеева. Периодическая таблица (периоды и группы).
- •9. Химическая связь: понятие, параметры (энергия связи, длина связи, валентный угол), потенциал ионизации, сродство к электрону, электроотрицательность.
- •11. Метод валентных связей (- и -связи), метод молекулярных орбиталей, гибридизация атомных орбиталей.
- •10.Типы химической связи: ионная, ковалентная ( типы ковалентной связи, полярность), координационная, металлическая, водородная.
- •12. Термодинамические системы: открытые, закрытые, изолированные; гомогенные и гетерогенные. Параметры системы.
- •13. Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
- •14.Первое (закон сохранения энергии) и второе начало термодинамики.
- •15. Тепловой эффект реакции: экзо- и эндотермические реакции; закон Гесса; (стандартная) теплота образования вещества.
- •16.Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа.
- •18. Обратимые и необратимые реакции. Химическое равновесие; константа равновесия, влияние температуры на константу равновесия. Принцип Ле-Шателье.
- •19. Понятие раствора. Способы выражения состава раствора (массовая доля, молярность, моляльность, нормальность).
- •20.Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированные растворы; насыщенный раствор.
- •21. Осмотическое давление. Законы Вант-Гоффа и Рауля.
- •23.Степень диссоциации. Сильные (активность, коэффициент активности, ионная сила) и слабые (константа диссоциации, закон разведения Оствальда) электролиты.
- •22. Растворы электролитов. Изотопический коэффициент. Теория электролитической диссоциации Аррениуса; определение кислот, оснований, солей по Аррениусу.
- •24. Малорастворимые электролиты, произведение растворимости.
- •25. Константа воды. Водородный показатель (pH).
- •26. Буферные растворы.
- •27.Гидролиз солей: типы, константа и степень гидролиза.
- •28. Окислительно-восстановительные реакции: степень окисления, окислитель и восстановитель (важнейшие окислители и восстановители), типы окислительно-восстановительных реакций.
- •30. Электродные процессы: двойной электрический слой, (стандартный) электродный потенциал.
- •29. Методы составления уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций).
- •31. Химические источники тока: гальванические элементы (эдс), топливные элементы, аккумуляторы.
- •32. Электролиз: понятие, отличие от гальванического элемента; электролиз расплавов солей и растворов электролитов. Закон Фарадея.
- •33. Коррозия металлов: понятие, виды (химическая, электрохимическая), защита металлов от коррозии.
- •34. Понятие о комплексных соединениях: строение, номенклатура.
- •35. Гетерогенные дисперсные системы (типы систем, поверхностные явления).
- •36. Химические свойства s-элементов, их оксидов и гидроксидов.
- •37. Жесткость воды (временная, постоянная), способы ее устранения.
связи C − H равноценны и располагаются симметрично друг другу. В рамках МВС эти факты объясняются на основе концепции гибридизации атомных валентных орбиталей. Согласно ей в валентных состояниях электроны распределяются не на чистых S и P орбиталях, а на смешанных (гибридных). Число гибридных равно числу атомных орбиталей. Гибридные орбитали одинаковы по форме и энергии. В отличии от атомных орбиталей гибридные более вытянуты в направлении образования химической связи.
Типы гибридизаций:
SP3 – гибридизация – при взаимодействии 1S и 3P орбиталей,
SP2 – гибридизация – при взаимодействии 1S и 2P орбиталей,
SP – гибридизация – при взаимодействии 1S и 1P орбиталей
12. Термодинамические системы: открытые, закрытые, изолированные; гомогенные и гетерогенные. Параметры системы.
Химическая термодинамика – это раздел физической химии, которая изучает превращения различных видов энергии при химических реакциях, процессах растворения, кристаллизации. Химическая термодинамика исследует возможности и границы самопроизвольного протекания физических процессов. Объектом изучения в термодинамике является термодинамическая система, под которой понимают условно выделенную из пространства совокупность тел, между которыми возможен масса- и теплообмен.
Системы, которые могут обмениваться с окружающей средой и энергией и веществом называются открытыми. Системы, которые обмениваются только энергией, называются закрытыми.
Если между средой и системой отсутствует и тепло- и массообмен – это изолированная система.
Различают также гомогенные системы, состоящие из одной фазы и гетерогенные, состоящие из нескольких фаз. Реакции, которые протекают на границе раздела фаз – гетерогенные.
возможен масса- и теплообмен.
Системы, которые могут обмениваться с окружающей средой и энергией и веществом называются открытыми. Системы, которые обмениваются только энергией, называются закрытыми.
Если между средой и системой отсутствует и тепло- и массообмен – это изолированная система.
Различают также гомогенные системы, состоящие из одной фазы и гетерогенные, состоящие из нескольких фаз. Реакции, которые протекают на границе раздела фаз – гетерогенные.
Совокупность свойств системы называется состоянием системы. Одна и та же система может находиться в различных состояниях. Каждое состояние характеризуется определённым набором значений термодинамических параметров. Параметры, описывающие состояние системы, называются параметрами состояния.
Они делятся на интенсивные и экстенсивные. Интенсивные не зависят от размера системы, а зависят от температуры и давления, экстенсивные зависят от массы и объёма. Изменение одного из параметров приводит к изменению состояния в целом.
13. Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
Состояние системы и происходящие в ней изменения определяются с помощью функций состояния. Функции состояния – внутренняя энергия, энтропия, изобарный, изотермический потенциал.
Переход системы из 1-го состояния во 2-ое называется процессом.
1.T = const – изотермический процесс
2.V = const – изохорный процесс
3.P = const – изобарный процесс
Основной функцией
состояния системы является её полная
энергия, которая является суммой 3-х
состояний:
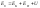 кинетическая энергия движущейся
системы, потенциальная энергия
обусловленная воздействием на систему
внешних силовых полей, внутренняя
энергия.
кинетическая энергия движущейся
системы, потенциальная энергия
обусловленная воздействием на систему
внешних силовых полей, внутренняя
энергия.
Экспериментально
внутреннюю энергию U
определить нельзя, можно определить
лишь её изменение
 :
:
 .
.
Энтальпия
– есть функция состояния системы, имеет
размерность энергии.

Энтропия
– функция меры беспорядка S,
она связана с термодинамической
вероятностью реализации данного
состояния вещества:
 ,
где k–
постоянная Больцмана, W
– термодинамическая вероятность, т.е.
число возможных микросостояний,
соответствующих данному макросостоянию
вещества.
,
где k–
постоянная Больцмана, W
– термодинамическая вероятность, т.е.
число возможных микросостояний,
соответствующих данному макросостоянию
вещества.
 – стандартная энтропия,
– стандартная энтропия,
 – её изменение.
– её изменение.
Химический
потенциал
– функция состояния. В условиях T
= const
определяется изменением энергии Гиббса
 :
:
 .
.






Изобарно-изотермический
потенциал (P,T
= const):

изохорно-изотермический
потенциал (V,T
= const):

14.Первое (закон сохранения энергии) и второе начало термодинамики.
Если система
обменивается с внешней средой тепловой
энергией Q
и механической энергией (работой) A
и переходит из 1-го состояния во 2-ое, то
согласно 1-му
началу термодинамики
– количество энергии, которое выделяется
или поглощается системой в виде теплоты
Q
и работы A,
равно изменению полной энергии системы
 ,
т.е. при переходе из 1-го состояния во
2-ое:
,
т.е. при переходе из 1-го состояния во
2-ое:
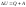 .
.
Для изохорного
процесса (при V
= const)
тепловой эффект реакции при температуре
T
соответствует изменению внутренней
энергии системы в ходе реакции:
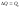 .
.
Для изобарного процесса (P = const):
 ,
следовательно
,
следовательно
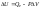 ,
откуда получаем
,
откуда получаем
 .
.
Функция
 обозначается через H
и называется энтальпия.
обозначается через H
и называется энтальпия.
2-ое начало термодинамики: В изолированных системах самопроизвольно протекают те процессы и реакции, в ходе которых энтропия S возрастает.
Процессы, для
которых
 – расширение газов, фазовые превращения
(их же в газ), процессы растворения,
плавление, кипение, диссоциация
соединений, нагревание.
– расширение газов, фазовые превращения
(их же в газ), процессы растворения,
плавление, кипение, диссоциация
соединений, нагревание.
Процессы, для
которых
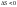 – сжатие газов, конденсация, кристаллизация,
охлаждение.
– сжатие газов, конденсация, кристаллизация,
охлаждение.
Если в ходе реакции
объём возрастает, то
 .
.

 возрастает
возрастает

В отличие от энтальпии H и внутренней энергии U для чистых веществ можно определить абсолютное значение энтропии S.
Энтропия, определяемая
в стандартных условиях ( ,
,
 )
называется стандартной
)
называется стандартной
 .
.
 – для простых веществ.
– для простых веществ.
Изменение энтропии
 в ходе химической реакции определяется
как
в ходе химической реакции определяется
как
 продуктов реакции за вычетом
продуктов реакции за вычетом
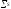 исходных реагентов с учётом
стехиометрических коэффициентов:
исходных реагентов с учётом
стехиометрических коэффициентов:
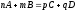
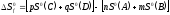 .
.

15. Тепловой эффект реакции: экзо- и эндотермические реакции; закон Гесса; (стандартная) теплота образования вещества.
Энергия, которая выделяется и поглощается, называется тепловым эффектом химической реакции.
Если прочность связей в продуктах реакции больше чем в реагентах, то выделяется энергия в виде теплоты Q.
Процессы, протекающие с выделением теплоты называются экзотермическими, а с поглощением – эндотермическими.
Тепловой эффект эндотермической реакции считают положительным «+» (поглощение тепла), а экзотермической – отрицательным «−» (выделение тепла).
Закон Гесса: тепловой эффект химической реакции протекающий или при P = const или при V = const не зависит от числа промежуточных стадий, а определяется лишь конечным и начальным состоянием системы. Тепловой эффект реакции зависит от природы регентов и продуктов реакции, их агрегатного состояния, условия проведения реакции, а также от количества, участвовавшего в реакции.
Поэтому тепловой
эффект принято относить к 1-му моль
вещества и определять его в стандартных
условиях:

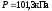 ,
,
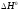 .
.
16.Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа.
Химическая кинетика – раздел химии, который изучает скорость химической реакции и факторы влияющие на неё.
Реакции могут быть:
-
1. гомогенными – протекают в одной среде (в газовой фазе); проходят во всём объёме
-
2. гетерогенными – протекают не в одной среде (между веществами, находящимися в разных фазах); проходят на границе раздела
Под скоростью химической реакции понимают число элементарных актов реакции, проходящих в единицу времени в единице объёма (для гомогенных реакций) и на единицу поверхности (для гетерогенных реакций).
Так как при реакции
изменяется концентрация реагирующих
веществ, то скорость обычно определяют
как изменение концентрации реагентов
в единицу времени и выражают в моль/л∙сек.
При этом нет необходимости следить за
изменением концентрации всех веществ,
входящих в реакцию, поскольку
стехиометрический коэффициент в
уравнении реакции устанавливает
соотношение между концентрациями, т.е.
при
 скорость накопления аммиака вдвое
больше скорости расходования водорода.
скорость накопления аммиака вдвое
больше скорости расходования водорода.
Скорость химических реакций зависит:
-
от природы реагирующих веществ, от концентрации реагентов, от катализатора, от температуры, от степени измельчения твёрдого вещества (гетерогенные реакции), от среды (растворы), от формы реактора (цепные реакции), от освещения (фотохимические реакции)
-
Основной закон химической кинетики – закон действующих масс: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в реакции
 :
:
 ,
где k
– постоянная скорости химической
реакции
,
где k
– постоянная скорости химической
реакции -
Физический смысл
 при
при
 .
. -
Если в реакции участвуют не 2-е частицы, а более
 ,
то:
,
то:
 ~
~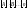 в степенях, равных стехиометрическим
коэффициентам, т.е.:
в степенях, равных стехиометрическим
коэффициентам, т.е.:
 ,
где
,
где -
 – показатель
порядка реакции в целом (реакции
первого, второго, третьего … порядков).
– показатель
порядка реакции в целом (реакции
первого, второго, третьего … порядков). -
Число частиц, участвующих в этом акте реакции определяет молекулярность реакции:
P
= 101,3кПа,

При термохимических
расчётах важными являются
 (
( )
– это тепловой эффект реакций образования
вещества из простых веществ. По величинам
и знакам энтальпии можно судить об
устойчивости соединения относительно
его распада на простые вещества.
)
– это тепловой эффект реакций образования
вещества из простых веществ. По величинам
и знакам энтальпии можно судить об
устойчивости соединения относительно
его распада на простые вещества.
Если
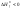 ,
то соединение более устойчиво, чем
простые вещества, из которых оно
образовано. Стандартный тепловой эффект
химической реакции равен сумме
стандартных энтальпий образования
продуктов реакций за вычетом суммы
стандартных энтальпий образования
реагентов с учётом стехиометрических
коэффициентов:
,
то соединение более устойчиво, чем
простые вещества, из которых оно
образовано. Стандартный тепловой эффект
химической реакции равен сумме
стандартных энтальпий образования
продуктов реакций за вычетом суммы
стандартных энтальпий образования
реагентов с учётом стехиометрических
коэффициентов:

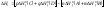
где
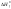 =[Дж/моль],
=[Дж/моль],
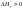 – эндотермический процесс,
– эндотермический процесс,
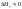 – экзотермический процесс;
– экзотермический процесс;
 – для простых веществ.
– для простых веществ.
 мономолекулярная
(
мономолекулярная
(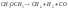 )
)
 бимолекулярная(
бимолекулярная( )
)
 тримолекулярная
тримолекулярная
Больше 3-х не бывает, т.к. столкновение более 3-х частиц сразу – маловероятно.
Зависимость
скорости реакции от температуры
определяется эмпирическим правилом
Вант-Гоффа:
при увеличении температуры на
 ,
скорость химической реакции увеличивается
в 2 – 4 раза:
,
скорость химической реакции увеличивается
в 2 – 4 раза:

17. Энергия активации (активированный комплекс, энергетические диаграммы экзо- и эндотермических реакций, влияние катализаторов, уравнение Аррениуса). Катализ (гомогенный и гетерогенный; ферменты, промоторы, ингибиторы).
Не всякое столкновение молекул сопровождается их взаимодействием. Большинство молекул отскакивают как упругие шарики. И только активные при столкновении взаимодействуют друг с другом. Активные молекулы обладают некоторой избыточной Е по сравнению с неактивными молекулами, поэтому в активных молекулах связи между ними ослаблены.
Активированный комплекс

Энергия для перевода
молекулы в активное состояние – энергия
активации
 .
Чем она меньше, тем больше частиц
реагируют, тем больше скорость химической
реакции.
.
Чем она меньше, тем больше частиц
реагируют, тем больше скорость химической
реакции.
Изменение Е в ходе реакции:
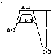
Е выделяется (экзотермическая)
С
увеличением температуры число активных
молекул растёт, поэтому
 увеличивается.
увеличивается.
Константа
 химической реакции связана с
химической реакции связана с
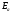 :
:
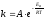 ,
где
,
где
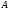 – предэкспоненциальный
множитель (связан с вероятностью и
числом столкновений).
– предэкспоненциальный
множитель (связан с вероятностью и
числом столкновений).
