
Механизм кристаллизации полимеров. Многие полимеры, так же как и низкомолекулярные жидкости, способны кристаллизоваться из расплава при охлаждении ниже температуры плавления кристаллической фазы. Однако процесс этот намного сложней, чем в низкомолекулярных жидкостях, вследствие ограниченной подвижности полимерных цепей, наличия зацеплений и нерегулярности структуры, способной полностью подавить кристаллизацию (полимеры a-олефинов при наличии в боковых цепях более 5 атомов углерода не кристаллизуются). Именно из-за ограниченной подвижности полимеры кристаллизуются при температуре значительно ниже температуры плавления. Например, статистический сополимер этилена с пропиленом (RCP) плавится при температуре 145 0С, а кристаллизоваться начинает при температуре 112 0С. Кристаллизация полимеров из расплава при отсутствии внешнего давления происходит, как правило, со складыванием цепей. Структура с полностью вытянутыми цепями (КВЦ) термодинамически более выгодна, чем структура со сложенными цепями, но энергия активации образования кристалла с вытянутыми цепями намного выше, поэтому в большинстве случаев образуются кинетически более выгодные кристаллы со сложенными цепями (КСЦ). Структура полимера после охлаждения представляет собой совокупность большого числа складчатых (ламеллярных) кристаллитов (так называемых сферолитов), соединённых проходными молекулами. По термодинамическим и кинетическим причинам гибкоцепные полимеры никогда не бывают полностью кристаллическими, поэтому их называют аморфно-кристаллическими, или частично-кристаллическими. Структуру такого полимера можно представить в виде трёхмерной сетки, узлы которой образованы кристаллитами и соединены аморфными участками, состоящими из проходных цепей. Именно малой долей держащих нагрузку цепей обусловлена низкая реальная прочность кристаллизующихся полимеров (всего несколько процентов от теоретической). Следует отметить, что изучение механизма кристаллизации полимеров продолжается до сих пор, и существует несколько теорий, объясняющих этот процесс. Тем не менее, абсолютно точно известно, что для кристаллизации полимеров необходимо следующее:
Молекулярная структура должна быть достаточно регулярной, чтобы образовывать кристаллы.
Температура кристаллизации должна быть ниже температуры плавления и существенно выше температуры стеклования. Процесс кристаллизации полимеров состоит из 2-х основных стадий - стадии формирования первичных зародышей и последующего роста кристаллов, образовавшихся на них. Зародышами кристаллизации могут служить любые микронеоднородности - агрегаты макромолекул, сохраняющиеся в расплаве при температурах, значительно превышающих температуру плавления, или посторонние микровключения (остатки катализатора, пыль и т.п.). Рост сферолитов продолжается до тех пор, пока фронт растущего кристалла не столкнётся с фронтом соседнего растущего кристалла. Скорость роста сферолитов возрастает с понижением температуры, и достигает максимума примерно в середине между температурой плавления и стеклования, а затем падает вследствие снижения подвижности полимерных цепей. На скорость роста кристаллов также влияют молекулярная масса и молекулярно-массовое распределение (ММР) полимера. В одной из работ итальянских исследователей было обнаружено, что скорость роста кристалла существенно замедлялась с ростом молекулярной массы полимера, в то время как скорость образования зародышей (скорость нуклеации) существенно возрастала при снижении молекулярной массы и увеличением ММР. Похожие закономерности наблюдались и при исследовании ПЭТ. Таким образом, становится очевидным, что размер кристаллитов в большой степени зависит от количества зародышей кристаллизации. Именно на этом и основано действие нуклеирующих добавок, которые создают в расплаве полимера большое количество зародышей, что приводит к практически одновременному образованию большого количества мелких кристаллитов, не имеющих достаточного пространства для роста. Хорошо известно, что чем меньше размер сферолита, тем выше физико-механические и оптические свойства полимера. При переработке полимеров расплав подвергается воздействию высокого давления и сдвиговых напряжений. Многочисленные эксперименты прямо подтверждают влияние этих двух факторов на процесс кристаллизации аморфно-кристаллических полимеров. Доказано, что высокое давление вынуждает полимерные цепи укладываться плотнее. Более того, рост давления приводит к повышению температуры плавления. Например, температура плавления полипропилена растёт от 170 0С при атмосферном давлении до 190 0С при давлении 500 бар. В лабораторных условиях, при давлениях, существенно превышающих развивающиеся при переработке, возможно получение кристаллов с вытянутыми цепями.
РАСТВОРЫ - системы, состоящие из молекул, атомов и (или) ионов нескольких различных типов, при этом числа различных частиц не находятся в каких либо определённых стехиометрических соотношениях друг с другом (что отделяет растворы от химических соединений). К растворам обычно относят такие многокомпонентные системы, в которых при неизменных внеш. условиях достигается состояние термодинамического равновесия.
Агрегатное состояние раствора может быть твёрдым (твёрдые растворы), жидкокристаллическим (жидкие кристаллы ),жидким или газообразным. Будучи макроскопически пространственно однородными, на молекулярных масштабах Р. могут обладать своеобразной микроструктурой (микрогетерогенные растворы, или ассоциирующие коллоиды), к-рая определяется темп-рой, давлением и составом Р. Если микроструктура Р. является регулярной (в одном, двух или трёх измерениях), то его относят к лиотропным жидким кристаллам. Жидкие Р. с нерегулярной микроструктурой (обычно многокомпонентные, содержащие органич. вещества и соли) наз. эмульсиями (микроэмульсиями). Суспензии частиц размером от неск. нм до тысяч нм относят к коллоидным Р.
В том случае, когда молекулы растворённого вещества диссоциируют на ионы, Р. относят к особому классу - Р. электролитов. Отличит. свойствами обладают Р. полимеров.
Термодинамические свойства растворов
Термодинамические свойства растворов описываются общими для многокомпонентных систем соотношениями термодинамики. Число веществ n, количества которых в состоянии полного термодинамического равновесия могут быть заданы произвольно, называются числом независимых компонент раствора. Если число молекул (атомов) одной из компонент системы N намного превышает числа N1, ..., Nn-1 молекул остальных компонент, раствор называется разбавленным (слабым). Вещество, содержащее N частиц, в этом случае наз. растворителем, остальные компоненты - растворёнными веществами.
Диаграммы плавления и кипения растворов. В отличие от чистых веществ, изменение агрегатного состояния Р. происходит в нек-ром интервале изменения концентраций компонент, темп-ры и(или) давления. Простейший случай равновесия двух фаз реализуется, когда обе компоненты, образующие Р., в обеих фазах смешиваются в произвольных отношениях. Кривые равновесия в этом случае не имеют максимумов и минимумов и образуют характерную "сигару" (диаграмма Т - с, с - концентрация; рис. 1). Пусть для определённости рассматриваемые фазы представляют собой жидкость (низкотемпературная фаза II) и пар (высокотемпературная фаза I). Если изображающая точка системы (Т, с)лежит выше кривой FAG, то агрегатное состояние системы - пар, если ниже кривой FCG - жидкость. Заштрихованная область между кривыми FAG и FCG соответствует равновесию двух фаз (представляющих собой т. н. насыщенные растворы),
концентрации к-рых характеризуются растворимостью веществ и равны с' и с'', в точке В массы определяются "правилом рычага", согласно к-рому кол-ва молекул в фазах I и II обратно пропорциональны длине отрезков соответственно АВ и ВС:
В случае равновесия системы жидкость - пар кривая FAG наз. кривой конденсации, a FCG - кривой кипения. В случае равновесия твёрдой и жидкой фаз кривая FAG наз. кривой ликвидуса, a FCG - кривой солидуса.
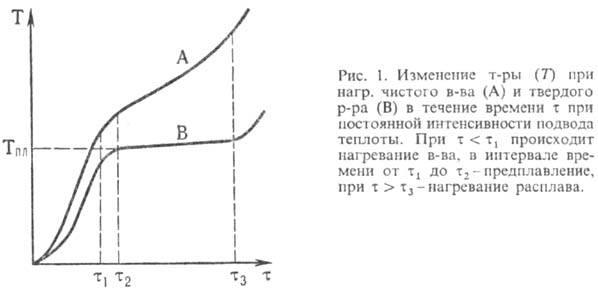
Плавление это переход вещества из твердого кристаллического состояния в жидкое при нагревании. Плавление является фазовым переходом первого рода, который происходит с поглощением теплоты. Главными характеристиками такого перехода чистых веществ являются температура и энтальпия плавления. Если состав плавящегося вещества не изменяется, плавление называется конгруэнтным, если изменяется - ин конгруэнтным.
Плавлению предшествуют интенсивное разупорядочивание кристаллов вещества и проявление жидких микроучастков на поверхности кристаллов и вблизи межкристаллитных границ. По мере нагревания микроучастки укрупняются и сливаются, формируя жидкую фазу, а кристаллы рассыпаются на фрагменты и уменьшаются в размерах до полного исчезновения. Теплота, подводимая к веществу при плавлении, расходуется в основном на разрыв межатомных связей, а не на его нагревание. Поэтому чистые крупнокристаллические вещества в течение плавления не изменяют свою температуру (рис. 1). Для таких веществ температура плавления служит идентифицирующей характеристикой и критерием их чистоты. Плавление веществ со сходной кристаллической структурой описывается эмпирически формулой Линдемана:
![]() ,
,
где Тпл - температура плавления; А - постоянная для группы веществ; M и V – молекулярная масса и объем веществ; -температура Дебая.
Температура плавления большинства чистых веществ (за исключением так называемых аномальных - Bi, Ga, Sb, льда и др.) возрастает с увеличением давления. Для давлений, меньших 105 Па, зависимость Тпл от давления p приближенно выражается эмпирической формулой Симона:
 ,
,
где а и с - постоянные для данного вещества; p0 и T0 - координаты тройной точки.
ПАРАМЕТРЫ ПЛАВЛЕНИЯ НЕКОТОРЫХ ВЕЩЕСТВ
|
|
|
|
|
|
|
|
|
в-во |
Тпл, К |
а, ГПа |
с |
|
|
|
Kr |
115,78 |
0,2376 |
1,617 |
|
|
|
Xe |
161,36 |
0,2610 |
1,589 |
|
|
|
In |
429,93 |
3,58 |
2,30 |
|
|
|
Sn |
505,05 |
5,70 |
3,40 |
|
|
|
NaCl |
1074,15 |
1,67 |
2,70 |
|
|
|
Fe |
1808 |
107,00 |
1,76 |
|
|
|
Rh |
2236 |
50,00 |
1,30 |
|
|
|
|
|
|
|
|
При p > 105 Па функция Тпл (р) может иметь максимумы (рис. 2). Разница между температурами плавления полиморфных модификаций одного и того же вещества достигает 270 К (например, две кубич. модификации KCl), а кристаллов с разл. изотопным составом-5 К (напр., водород и дейтерий). Крупные кристаллы чистого в-ва плавятся при более высокой т-ре, чем мелкие. При размерах кристаллов d > 10 нм т-ра их плавления определяется по ф-ле:

где -уд.
поверхностная
энергия
кристаллов;
![]() -мол.
энтальпия
плавления
-мол.
энтальпия
плавления

Переход мелкокристаллич.
полидисперсных в-в в жидкое состояние
происходит не при постоянной т-ре, а в
интервале т-р (до неск. градусов):
начинается при т-ре плавления самых
мелких, а завершается при т-ре плавления
наиб. крупных кристаллов.
Твердые р-ры также плавятся в температурном
интервале, к-рый может достигать десятков
градусов и в соответствии с диаграммой
состояния
зависит от состава этих р-ров. Удельная
энтальпия плавления большинства в-в
находится в пределах 10-300 кДж/кг и
значительно уступает энтальпии
парообразования.
Возрастание при плавлении энтропии
![]() составляет
3-60 Дж/(моль·К); для большинства простых
в-в
составляет
3-60 Дж/(моль·К); для большинства простых
в-в
![]() не
превышает 6-11 Дж/(моль·К). Связь между
изменениями энтальпии,
энтропии
и объема в-в при плавлении и Тпл
описывается Клапейрона-Клаузиуса
уравнением.
не
превышает 6-11 Дж/(моль·К). Связь между
изменениями энтальпии,
энтропии
и объема в-в при плавлении и Тпл
описывается Клапейрона-Клаузиуса
уравнением.
Неорг. простые в-ва плавятся (рис. 3) при т-рах от 2,0 К (4He) до 3653 К (вольфрам). Среди соединений наиб. Тпл имеют HfN (3603 К), ZrC (3803 К), TaC (4258 К) и HfC (4163 К). Т-ра плавления металлов коррелирует с их способностью расширяться при нагр. (рис. 4).

Орг. в-ва плавятся при 80-550 К. Энтальпия плавления гомологов увеличивается с ростом мол. массы до предела, специфичного для каждого гомологич. ряда. В-ва, молекулы к-рых имеют сильно удлиненную форму, плавятся с переходом в жидкокристаллич. состояние. Кристаллич. полимеры плавятся в интервале т-р, к-рый определяется MMP и размерами кристаллитов полимеров.
Наряду с изменениями др. физ. св-в, при плавлении увеличивается также уд. объем в-в (кроме аномальных), но резко снижается сопротивление сдвигу.
Плавление играет важную роль в природе (таяние льда и снега на пов-сти Земли, плавление минералов с образованием магмы в ее недрах и т. д.), в науке и технике для литья, пайки, получения чистых в-в (зонная плавка, плавление с фракционной кристаллизацией и др.).
Лит.: Френкель Я. И., Кинетическая теория жидкостей. Собр. избр. трудов, т. 3, M.-Л., 1959; Термические константы веществ. Справочник, под ред. В. П. Глушко, в. 1-10, M., 1965-82; Уббелоде А., Плавление и кристаллическая структура, пер. с англ., M., 1969; Физический энциклопедический словарь, M., 1984, с. 535-36. И. В. Мелихов.
Кристаллизацией называют переход вещества из газообразного (парообразного), жидкого или твердого аморфного состояния в кристаллическое, а также переход из одного кристаллического состояния в другое (рекристаллизация, или вторичная кристаллизация). Кристаллизация является фазовым переходом первого рода. Кристаллизация из жидкой или газовой фазы - экзотермический процесс, при котором выделяется теплота фазового перехода, или теплота кристаллизации; при этом изменение энтропии в большинстве случаев составляет [в Дж/(моль.К)]: для простых веществ 5-12, для неорганических соединений 20 - 30, для органических соединений 40-60. Рекристаллизация может протекать с выделением либо поглощением теплоты. В промышленности и лабораторной практике кристаллизацию используют для получения продуктов с заданными составом, содержанием примесей, размерами, формой и дефектностью кристаллов, а также для фракционного разделения смесей и др.
Физико-химические
основы процесса. Условия,
при которых возможна кристаллизация,
определяются видом диаграммы состояния.
Чтобы кристаллизация протекала с
конечной скоростью, исходную фазу
необходимо переохладить (перегреть),
пересытить кристаллизующимся веществом
или внести во внешнее поле, снижающее
растворимость кристаллизующейся фазы.
В переохлажденной (перегретой) либо
пересыщенной фазе происходит зарождение
новой фазы - образуются центры
кристаллизации, которые превращаются
в кристаллы и растут, как правило, изменяя
форму, содержание примесей и дефектность.
Центры кристаллизации возникают
гомогенно в объеме начальной фазы и
гетерогенно на поверхностях посторонних
твердых частиц (первичное зародышеобразование),
а также вблизи поверхности ранее
сформировавшихся кристаллов новой фазы
(вторичное зародышеобразование).
Общее число центров кристаллизации,
возникших в единице объема раствора
или расплава в 1 с, или суммарную
интенсивность их первичного и вторичного
образования, находят по ф-ле:
 где
-кинетич.
коэф. первичного зародышеобразования,
к-рый рассматривают в рамках кинетич.
теории образования новой фазы; R - газовая
постоянная;
T - т-ра кристаллизации; у-уд. поверхностная
своб. энергия кристаллов;
Vт
- молярный объем новой фазы; =HS
и S = (Т0-7)/Т0
для расплавов,
=RT1n(S
+ 1) и S = (c-c0)/c0
для р-ров; H-энтальпия
кристаллизации ; с - концентрация
кристаллизующегося в-ва; Т0
и c0
- соотв. т-ра
плавления
в-ва и концентрация
насыщ. р-ра; Eакт
- энергия
активации
перехода молекул
из среды в центры кристаллизации; Iат
- интенсивность
вторичного зародышеобразования
в объеме начальной фазы. Для измерения
a, Eaкт
и Iвт находят
зависимость интенсивности образования
центров кристаллизации от т-ры, пересыщения
и концентрации
посторонних твердых частиц. Величина
Iи
проходит через один или неск. максимумов
(рис. 1) с возрастанием переохлаждения
(пересыщения) и увеличивается при мех.
воздействиях (перемешивание,
где
-кинетич.
коэф. первичного зародышеобразования,
к-рый рассматривают в рамках кинетич.
теории образования новой фазы; R - газовая
постоянная;
T - т-ра кристаллизации; у-уд. поверхностная
своб. энергия кристаллов;
Vт
- молярный объем новой фазы; =HS
и S = (Т0-7)/Т0
для расплавов,
=RT1n(S
+ 1) и S = (c-c0)/c0
для р-ров; H-энтальпия
кристаллизации ; с - концентрация
кристаллизующегося в-ва; Т0
и c0
- соотв. т-ра
плавления
в-ва и концентрация
насыщ. р-ра; Eакт
- энергия
активации
перехода молекул
из среды в центры кристаллизации; Iат
- интенсивность
вторичного зародышеобразования
в объеме начальной фазы. Для измерения
a, Eaкт
и Iвт находят
зависимость интенсивности образования
центров кристаллизации от т-ры, пересыщения
и концентрации
посторонних твердых частиц. Величина
Iи
проходит через один или неск. максимумов
(рис. 1) с возрастанием переохлаждения
(пересыщения) и увеличивается при мех.
воздействиях (перемешивание,
 Рис.
I Зависимость скорости зародышеобразования
от переохлаждения расплава InSb: I расплав
массой 16 г перегревался в кварцевом
тигле на 15 К выше температуры плавления
в течение 9 мин и затем охлаждался со
скоростью 1 град/мин; 2 то же, на 55 К в
течение 20 с.
Рис.
I Зависимость скорости зародышеобразования
от переохлаждения расплава InSb: I расплав
массой 16 г перегревался в кварцевом
тигле на 15 К выше температуры плавления
в течение 9 мин и затем охлаждался со
скоростью 1 град/мин; 2 то же, на 55 К в
течение 20 с.
ультразвук)
или под влиянием ионизирующего
излучения.
При росте кристаллов
сначала кристаллизующееся в-во
адсорбируется на пов-сти сформировавшегося
кристаллика, а затем встраивается в его
кристаллич. решетку: при сильном
переохлаждении равновероятно на любом
участке пов-сти (нормальный рост), при
слабом - слоями тангенциально на ступенях,
образованных винтовыми дислокациями
или двухмерными зародышами (послойный
рост). Если переохлаждение ниже нек-рого
значения, наз. пределом морфологич.
устойчивости, нормально растущий
кристалл
повторяет форму (обычно округлую)
теплового либо концентрац. поля вокруг
него, а послойно растущий кристалл
имеет форму многогранника. При превышении
указанного предела растут древовидные
кристаллы
(дендриты).
Количественно рост
кристаллов
характеризуют линейной скоростью,
равной скорости перемещения их пов-сти
в нормальном к ней направлении. В пром-сти
используют эффективную
линейную скорость роста (увеличение в
1 с радиуса шара, объем к-рого равен
объему кристалла):
Iэфф=Snехр(Eр/RT),
где -
кинетич. коэф. роста (10-5-10-14
м/с), n-параметр роста (обычно 1-3), Ер
- энергия
активации
роста (10-150 кДж/моль).
Параметры ,
n и Eр находят,
измеряя Iэфф
при разных т-рах и пересыщениях р-ра или
переохлаждениях расплава.
С увеличением переохлаждения Iэфф
проходит через максимум аналогично I.
Скорость роста может лимитироваться
массо- и теплообменом
кристаллов
со средой (соотв. внешнедиффузионный и
теплообменный режимы роста), скоростью
хим. взаимод. кристаллизующегося
компонента с др. компонентами среды
(внешнекинетич. режим) или процессами
на пов-сти кристаллов
(адсорбционно-кинетич. режим). Во
внешнекинетич. режиме Iэфф
возрастает с повышением концентраций
реагентов
и катализаторов,
во внешнедиффузионном и теплообменном
режимах - с увеличением интенсивности
перемешивания,
в адсорбционно-кинетич. режиме - с
возрастанием поверхностной дефектности
кристаллов
и уменьшением концентрации
ПАВ. При высоких
скоростях роста кристаллы
приобретают значит. число неравновесных
дефектов
(вакансий, дислокаций
и др.). При превышении предела морфологич.
устойчивости в объем кристаллов
попадают трехмерные включения среды,
замурованные между ветвями дендритов
(окклюзия).
Состав кристаллов
из-за окклюзии
приближается к составу среды тем больше,
чем выше Iэфф.
При своем росте кристаллы
захватывают любую присутствующую в
среде примесь, причем концентрация
захваченной примеси зависит от скорости
роста. Если
кристаллизация происходит в р-ре и
кристаллы
после завершения роста продолжают
контактировать со средой, то неравновесно
захваченная примесь выбрасывается из
кристаллов
в среду, а их структура совершенствуется
(структурная перекристаллизация).
Одновременно в перемешиваемой среде
при столкновениях кристаллов
друг с другом и со стенками кристаллизатора
возникают дополнит. структурные дефекты.
Поэтому в системе постепенно устанавливается
стационарная дефектность кристаллов,
к-рая зависит от интенсивности
перемешивания.
В наиб. распространенном
случае образования при кристаллизации
множества кристаллов
(массовая кристаллизация) выделяющаяся
фаза полидисперсна, что обусловлено
неодновременностью зарождения кристаллов
и флуктуациями их роста. Мелкие кристаллы
более р-римы, чем крупные, поэтому при
убывающем пересыщении наступает момент,
когда среда, оставаясь пересыщенной
относительно последних, становитcя
 Рис.
2. Функция распределения кристаллов
по размерам (обычным r и наиб. вероятным
rA)при
изотермической (298 К) периодич.
кристаллизации из водного р-ра в
кристаллизаторе с мешалкой
(число Re=104):
1 BaSO4,
исходное пересышение S0=500.
rA=7.6
мкм; 2 - K2SO4,
высаливание
метанолом
(1.1)rA=1
мкм; t время процесса.
Рис.
2. Функция распределения кристаллов
по размерам (обычным r и наиб. вероятным
rA)при
изотермической (298 К) периодич.
кристаллизации из водного р-ра в
кристаллизаторе с мешалкой
(число Re=104):
1 BaSO4,
исходное пересышение S0=500.
rA=7.6
мкм; 2 - K2SO4,
высаливание
метанолом
(1.1)rA=1
мкм; t время процесса.
насыщенной относительно
мелких кристаллов.
С этого момента начинаются их растворение
и рост крупных кристаллов
(освальдoво созревание), в результате
чего средний размер кристаллов
возрастает, а их число уменьшается.
Одновременно в перемешиваемой среде
кристаллы
раскалываются при соударениях и через
нек-рое время приобретают стационарную
дисперсность,
определяемую интенсивностью мех.
воздействия. Осн.
количеств, характеристика массовой
кристаллизации - ф-ция распределения
кристаллов
по размеру f(r,t)=dN/dr, где N - число кристаллов,
размер к-рых меньше текущего размера
r, в единице объема в момент t. Эта ф-ция
часто имеет колоколообразный вид (рис.
2); восходящая ее ветвь чувствительна в
осн. к зародышеобразованию,
росту, раскалыванию и растворению
(при созревании) кристаллов,
нисходящая к росту
и образованию их агрегатов. Если среднее
квадратичное отклонение размера
кристаллов
от среднего не превышает половины,
последнего, упомянутая ф-ция наз. узкой,
если превышает - широкой. Изменение
ф-ции f(r,t) при кристаллизации описывается
ур-нием:
 где
a - коэф. флуктуации скорости роста
кристаллов;
Dк
и vк -
соотв. коэф. диффузии
и скорость перемещения кристаллов
в среде; Iar
и Iр -
соотв. интенсивность образования
кристаллов
данного размера за счет слипания более
мелких частиц и раскалывания кристаллов.
Система ур-ний
материального и теплового балансов,
ур-ния (2), а также ур-ния, связывающие
размеры и скорость роста кристаллов
с их формой, дефектностью и содержанием
примесей, - основа моделирования
и расчета массовой кристаллизации и
выбора оптим. условий ее реализации.
Массовую кристаллизацию осуществляют
периодически или непрерывно. При
периодич. кристаллизации охлаждают
расплав
или насыщ. р-р (пар),
испаряют р-ритель, добавляют высаливающие
агенты (см. ниже) или смешивают порции
реагентов,
образующих продукционные кристаллы.
При непрерывной кристаллизации в
кристаллизатор вводят потоки расплава,
пересыщенного р-ра либо реагентов
и непрерывно отводят кристаллич. продукт.
При пeриодич. процессе
скорость кристаллизации, определяемая
по ф-ле:
где
a - коэф. флуктуации скорости роста
кристаллов;
Dк
и vк -
соотв. коэф. диффузии
и скорость перемещения кристаллов
в среде; Iar
и Iр -
соотв. интенсивность образования
кристаллов
данного размера за счет слипания более
мелких частиц и раскалывания кристаллов.
Система ур-ний
материального и теплового балансов,
ур-ния (2), а также ур-ния, связывающие
размеры и скорость роста кристаллов
с их формой, дефектностью и содержанием
примесей, - основа моделирования
и расчета массовой кристаллизации и
выбора оптим. условий ее реализации.
Массовую кристаллизацию осуществляют
периодически или непрерывно. При
периодич. кристаллизации охлаждают
расплав
или насыщ. р-р (пар),
испаряют р-ритель, добавляют высаливающие
агенты (см. ниже) или смешивают порции
реагентов,
образующих продукционные кристаллы.
При непрерывной кристаллизации в
кристаллизатор вводят потоки расплава,
пересыщенного р-ра либо реагентов
и непрерывно отводят кристаллич. продукт.
При пeриодич. процессе
скорость кристаллизации, определяемая
по ф-ле:
![]() ,
где
и V - соотв. плотность твердой фазы и
объем системы, сначала медленно растет
(период
индукции),
затем резко увеличивается в результате
одновременного возрастания r и f и, пройдя
через максимум, уменьшается (рис. 3)
вследствие снижения Iэфф.
В периоды
индукции
и увеличения скорости кристаллизации
в системе преобладают зарождение и рост
кристаллов,
в период уменьшения скорости - их рост,
агрегация и раскалывание и далее
-освальдово созревание и структурная
перекристаллизация.
Период
индукции
сокращается под влиянием факторов,
к-рые ускоряют зародышеобразование
и рост кристаллов.
Так, при охлаждении расплавов
этот период с повышением интенсивности
охлаждения сначала уменьшается, а затем
,
где
и V - соотв. плотность твердой фазы и
объем системы, сначала медленно растет
(период
индукции),
затем резко увеличивается в результате
одновременного возрастания r и f и, пройдя
через максимум, уменьшается (рис. 3)
вследствие снижения Iэфф.
В периоды
индукции
и увеличения скорости кристаллизации
в системе преобладают зарождение и рост
кристаллов,
в период уменьшения скорости - их рост,
агрегация и раскалывание и далее
-освальдово созревание и структурная
перекристаллизация.
Период
индукции
сокращается под влиянием факторов,
к-рые ускоряют зародышеобразование
и рост кристаллов.
Так, при охлаждении расплавов
этот период с повышением интенсивности
охлаждения сначала уменьшается, а затем
 Рис.
3. Типичное изменение скорости периодич.
кристаллизации: t - время процесса;
длительность периода
индукции;
A - момент появления
новой фазы; В - начало стадии структурной
перeкристаллизации и освальдова
созревания.
Рис.
3. Типичное изменение скорости периодич.
кристаллизации: t - время процесса;
длительность периода
индукции;
A - момент появления
новой фазы; В - начало стадии структурной
перeкристаллизации и освальдова
созревания.
возрастает из-за
экстремальной зависимости скоростей
зарождения и роста кристаллов
от переохлаждения; если темп охлаждения
достаточно велик, расплав
твердеет, оставаясь аморфным (см.
Стеклообразное
состояние).
Для сокращения периода
индукции
в систему добавляют кристаллы
продукта (затравку), к-рые растут, что
приводит к увеличению скорости
кристаллизации. В результате выделения
при росте кристаллов
теплоты кристаллизации снижается
переохлаждение и замедляется
зародышеобразование.
При малых переохлаждениях (пересыщениях)
зародыши вообще не возникают, и затравка,
введенная в систему в виде единичных
кристаллов,
может вырасти в монокристалл,
а в виде порошка-в т. наз. монодисперсный
продукт с узкой ф-цией f(r, t). При
непрерывной кристаллизации ф-ция f(r,t)
в сопоставимых условиях перемешивания
шире, чем при периодич. кристаллизации,
что объясняется разбросом времен
пребывания кристаллов
в кристаллизаторах непрерывного
действия. Чтобы сузить эту ф-цию, режим
кристаллизации
приближают к режиму идеального вытеснения,
чтобы расширить - к режиму идеального
перемешивания
(см. Структура
потоков).
При малом пересыщении системы непрерывная
кристаллизация устойчива к флуктуациям
внеш. условий; при высоком пересыщении
его значение и размер кристаллов
колеблются в ходе кристаллизации.
В хим. и смежных отраслях
пром-сти, а также в лабораториях преим.
применяют кристаллизацию из расплавов
и р-ров, реже - кристаллизацию из паровой
и твердой фаз. Кристаллизацию
из расплавов
используют гл. обр. для отверждения
расплавленных в-в и, кроме того, для их
фракционного разделения и выращивания
монокристаллов.
Отверждение
в-в в виде отливок (блоков) осуществляют
в спец. формах. В малотоннажных произ-вах
(напр., реактивов) обычно применяют
отдельные формы определенных размеров
или конфигурации, в к-рых расплав
охлаждается путем естеств. теплообмена
с окружающей
средой; в
крупнотоннажных произ-вах (нафталина
и др.). Кристаллизацию проводят в
секционированных, трубчатых, конвейерных
и иных кристаллизаторах со встроенными
формами, принудительно охлаждаемыми
водой,
жидким NH3,
хладонами
и т.п. Для получения
продуктов в виде тонких пластинок или
чешуек используют непрерывно действующие
ленточные, вальцевые и дисковые
кристаллизаторы, где отверждение
происходит значительно интенсивнее,
чем в формах. В ленточном кристаллизаторе
(рис. 4) исходный расплав
 Рис.
4. Ленточный кристаллизатор: 1 лента; 2
приводные барабаны;
3 питающий бункер; 4 охлаждающее устройство;
5 отверждснный продукт.
Рис.
4. Ленточный кристаллизатор: 1 лента; 2
приводные барабаны;
3 питающий бункер; 4 охлаждающее устройство;
5 отверждснный продукт.
тонким слоем подается
на движущуюся металлич. ленту, на к-рой
он охлаждается до полного затвердевания.
В вальцевом аппарате (рис. 5) продукт
кристаллизуется на наружной пов-сти
охлаждаемого изнутри вращающегося
полого барабана
(вальца), частично погруженного в ванну
с расплавом;
кристаллы
снимаются с барабана
неподвижным ножом. В дисковых аппаратах
отверждение
продуктов происходит на пов-сти
охлаждаемых изнутри вращающихся дисков.
 Рис.
5. Вальцевый кристаллизатор: 1 барабан;
2 ванна;
3 нож; 4 труба для подачи хладагента;
5 форсунка; 6 расплав;
7 отвержденный продукт.
Рис.
5. Вальцевый кристаллизатор: 1 барабан;
2 ванна;
3 нож; 4 труба для подачи хладагента;
5 форсунка; 6 расплав;
7 отвержденный продукт.
При приготовлении
гранулир. продуктов расплав
диспергируют непосредственно в поток
хладагента
газообразного, в осн. воздуха
(произ-во аммиачной
селитры,
карбамида
и др.), или жидкого, напр. воды
либо масла
(произ-во пластмасс,
серы
и т. п.) в полых башнях или аппаратах с
псевдоожнжeнным слоем, где кристаллизуются
мелкие капли расплава
(см. Гранулирование).
Кристаллизацию из растворов
используют преим. для выделения ценных
компонентов из р-ров, а также их
концентрированна (см. Вымораживание)
и очистки в-в от примесей. В-ва, р-римость
к-рых сильно зависит от т-ры (напр., KNO3
в воде),
кристаллизуют охлаждением горячих
р-ров, при этом исходное кол-во р-рителя,
к-рый содержится в маточной жидкости,
в системе не изменяется (изогидрическая
кристаллизация). В малотоннажных
произ-вах применяют емкостные
кристаллизаторы периодич. действия,
снабженные охлаждаемыми рубашками. В
таких аппаратах р-р охлаждают при
непрерывном перемешивании
по определенной программе. Для
предотвращения интенсивной инкрустации
пов-стей охлаждения разность т-р между
р-ром и хладагентом
должна быть не более 8-10°С. В
крупнотоннажных произ-вах используют,
как правило, скребковые, шнековые,
дисковые, барабанные и роторные
кристаллизаторы непрерывного действия.
Скребковые аппараты обычно состоят из
неск. последовательно соединенных
трубчатых секций, в каждой из к-рых
имеется вал со скребками и к-рые снабжены
общей или индивидуальными охлаждающими
рубашками. При вращении вала скребки
очищают внутр. пов-сть охлаждаемых труб
от осевших на них кристаллов
и способствуют транспортированию
образовавшейся сгущенной суспензии
из секции в секцию. В шнековых
кристаллизаторах р-р перемешивают и
перемещают с помощью сплошных или
ленточных шнеков. Дисковые
кристаллизаторы снабжены неподвижными
либо вращающимися дисками.
В первом случае (рис. 6) по оси аппарата
расположен приводной вал со скребками
для очистки пов-стей дисков
от осаждающихся кристаллов;
исходный р-р подается в кристаллизатор
сверху, а образующаяся суспензия
последовательно проходит в пространстве
между охлаждаемыми дисками
и выгружается через ниж. штуцер. Во
втором случае вал с дисками
размещен внутри корыта или горизонтального
цилиндрич. сосуда;
кристаллы
снимаются с пов-сти дисков
неподвижными скребками.
 Осн.
элемент барабанного кристаллизатора
- полый барабан
с опорными бандажами, установленный
под углом 15° к горизонтальной оси и
вращающийся с частотой 5-20 мин-1.
Р-р, охлаждаемый водяной рубашкой или
воздухом
(к-рый нагнетают вентилятором через
внутр. полость барабана),
поступает с одного его конца, а суспензия
отводится с другого. Вязкие
р-ры (напр., жирных к-т) часто охлаждают
в роторных кристаллизаторах - цилиндрич.
аппаратах, внутри к-рых с большой
скоростью вращается ротор с ножами.
Последние под действием центробежной
силы прижимаются к внутр. пов-сти
кристаллизатора, очищая ее от осевших
кристаллов.
Р-р обычно подастся в аппарат под
избыточным давлением.
Для увеличения времени пребывания в
кристаллизаторе р-ра и большего его
переохлаждения последовательно соединяют
неск. аппаратов. При
использовании скребковых, шнековых,
роторных и иногда дисковых кристаллизаторов
часто образуются мелкие кристаллы
(0,1-0,15 мм), что приводит к увеличению
слеживаемости и адсорбц. загрязнения
продукта, а также ухудшает его
фильтруемость. Поэтому для укрупнения
кристаллов
продукта после упомянутых аппаратов
устанавливают т. наз. кристаллорастворители,
в к-рых концентрир. суспензия
выдерживается при медленном охлаждении,
что приводит к росту кристаллов
до 2-3 мм. Для получения
крупнокристаллич. однородных продуктов
часто применяют кристаллизаторы с
псевдоожиженным слоем (рис. 7). Исходный
р-р вместе с циркулирующим осветленным
маточником подается насосом
в теплообменник,
где в результате охлаждения р-р
пересыщается и поступает по циркуляц.
трубе в ниж. часть кристаллорастворителя,
в к-ром кристаллы
поддерживаются во взвешенном состоянии
восходящим потоком р-ра. Кристаллизация
происходит в осн. на готовых центрах
кристаллизации, при этом крупные
кристаллы
осаждаются на дно аппарата, откуда
удаляются в виде сгущенной суспензии.
Осветленный маточник разделяется на
две части: одна отводится из верх, части
аппарата, другая подается на рециркуляцию.
Осн.
элемент барабанного кристаллизатора
- полый барабан
с опорными бандажами, установленный
под углом 15° к горизонтальной оси и
вращающийся с частотой 5-20 мин-1.
Р-р, охлаждаемый водяной рубашкой или
воздухом
(к-рый нагнетают вентилятором через
внутр. полость барабана),
поступает с одного его конца, а суспензия
отводится с другого. Вязкие
р-ры (напр., жирных к-т) часто охлаждают
в роторных кристаллизаторах - цилиндрич.
аппаратах, внутри к-рых с большой
скоростью вращается ротор с ножами.
Последние под действием центробежной
силы прижимаются к внутр. пов-сти
кристаллизатора, очищая ее от осевших
кристаллов.
Р-р обычно подастся в аппарат под
избыточным давлением.
Для увеличения времени пребывания в
кристаллизаторе р-ра и большего его
переохлаждения последовательно соединяют
неск. аппаратов. При
использовании скребковых, шнековых,
роторных и иногда дисковых кристаллизаторов
часто образуются мелкие кристаллы
(0,1-0,15 мм), что приводит к увеличению
слеживаемости и адсорбц. загрязнения
продукта, а также ухудшает его
фильтруемость. Поэтому для укрупнения
кристаллов
продукта после упомянутых аппаратов
устанавливают т. наз. кристаллорастворители,
в к-рых концентрир. суспензия
выдерживается при медленном охлаждении,
что приводит к росту кристаллов
до 2-3 мм. Для получения
крупнокристаллич. однородных продуктов
часто применяют кристаллизаторы с
псевдоожиженным слоем (рис. 7). Исходный
р-р вместе с циркулирующим осветленным
маточником подается насосом
в теплообменник,
где в результате охлаждения р-р
пересыщается и поступает по циркуляц.
трубе в ниж. часть кристаллорастворителя,
в к-ром кристаллы
поддерживаются во взвешенном состоянии
восходящим потоком р-ра. Кристаллизация
происходит в осн. на готовых центрах
кристаллизации, при этом крупные
кристаллы
осаждаются на дно аппарата, откуда
удаляются в виде сгущенной суспензии.
Осветленный маточник разделяется на
две части: одна отводится из верх, части
аппарата, другая подается на рециркуляцию.
 Рис.
7. Кристаллизатор с псевдоожиженмым
слоем: I насос:
2 теплообмeнник: 3 циркуляционная труба;
4 кристаллорастворитель.
Рис.
7. Кристаллизатор с псевдоожиженмым
слоем: I насос:
2 теплообмeнник: 3 циркуляционная труба;
4 кристаллорастворитель.
В ряде cлучаев
кристаллизацию р-ров осуществляют
непосредственным смешением
их с жидкими, газообразными и испаряющимися
хладагентами
в смесительных, барботажных, распылительных
и др. аппаратах. Если
р-римость в-ва мало изменяется с изменением
т-ры (напр., NaCl в воде),
кристаллизацию проводят частичным или
практически полным испарением
р-ритeля путем выпаривания
насыщ. р-ра при почти постоянной т-ре
(изотермическая кристаллизация). По
конструкции выпарные кристаллизаторы
в значит. степени напоминают выпарные
аппараты
(см. Выпаривание)
и могут иметь внутр. или выносную (рис.
8) греющие камеры. В таком кристаллизаторе
исходный и циркулирующий р-ры, проходя
через камеру, нагреваются до т-ры кипения.
Образовавшаяся парожидкостная смесь
поступает в сепаратор, где пар
отделяется от р-ра. Кристаллы,
осаждающиеся в сепараторе, вместе с
маточной жидкостью
направляются в спец. аппарат, в к-ром
отделяются от нее и выводятся в виде
конц. суспензии;
 Рис.
8. Выпарной кристаллита гор: 1 выносная
греющая камера: 2 сепаратор: 3 циркуляционная
труба; 4 отделитель кристаллов.
Рис. 9. Вакуум-кристаллизатор:
1 - сепаратор: 2 - циркуляционная труба:
3 барометрическая труба; 4 гидрозатвор
Рис.
8. Выпарной кристаллита гор: 1 выносная
греющая камера: 2 сепаратор: 3 циркуляционная
труба; 4 отделитель кристаллов.
Рис. 9. Вакуум-кристаллизатор:
1 - сепаратор: 2 - циркуляционная труба:
3 барометрическая труба; 4 гидрозатвор
осветленный маточник возвращается в камеру. Для предотвращения инкрустации (обрастания) пов-стей нагрева р-р должен циркулировать в кристаллизаторе с достаточно большой скоростью (до 3 м/с), что часто достигается применением осевых насосов. При одновременном охлаждении и выпаривании р-рителя кристаллизацию осуществляют в вакуум-кристаллизаторах периодич. или непрерывного действия, с принудительной либо естественной циркуляцией р-ра. Р-р охлаждается вследствие адиабатич. испарения части р-рителя при создании в таком аппарате определенного разрежения. Кол-во испаренного р-рителя обычно составляет 8-10% от общей массы р-ра. В кристаллизаторе с естеств. циркуляцией (рис. 9) исходный р-р подается в ниж. часть циркуляц. трубы и вместе с циркулирующей суспензией поднимается вверх, где в результате понижения давления вскипает. Образовавшиеся пары проходят через сепаратор и поступают в барометрич. конденсатор. Пересыщенный р-р и выделившиеся кристаллы движутся вниз по барометрич. трубе, откуда кристаллы вместе с частью маточной жидкости выводятся в гидрозатвор. Для поддержания разрежения используют вакуум-насосы или пароструйные инжекторы. В крупнотоннажных произ-вах широко распространены многокорпусные вакуум-кристаллизац. установки с числом корпусов 4-24, в к-рых глубина разрежения постепенно возрастает от первого корпуса к последнему. Вакуум-кристаллизаторы более производительны и экономичны, чем выпарные кристаллизаторы. Кристаллизацию нек-рых в-в можно осуществить высаливанием. При выделении неорг. соед. используют орг. в-ва (напр., Na2SO4 кристаллизуют, добавляя к его водному р-ру метанол, этанол либо NH3) или содержащие одинаковый ион с выделяемым соед. (напр., FeSO4 кристаллизуют из травильных р-ров добавкой конц. H2SO4); при выделении орг. соединений - воду, водные р-ры неорг. солей и т. п. Введение в р-р в качестве высаливателей орг. в-в обычно удорожает процесс из-за сложности их регенерации. Кристаллизация из паровой фазы позволяет кристаллизовать в-ва, обладающие высоким парциальным давлением паров над твердой фазой и способные непосредственно переходить из газообразного состояния в кристаллическое (напр., иод, фталевый ангидрид). Такую кристаллизацию используют для выделения ценных компонентов из парогазовых смесей, получения аэрозолей, нанесения тонких кристаллич. слоев на пов-сть разл. тел (напр., в произ-ве полупроводниковых материалов) и т.д. Кристаллизацию аморфной твердой фазы и рекристаллизацию осуществляют, как правило, при т-рах, близких к т-рам плавления кристаллизуемых в-в. При этом в результате термодиффузионных процессов изменяется первичная кристаллич. структура в-ва либо происходят зарождение и рост кристаллов из аморфной фазы. Такую кристаллизацию применяют для получения в-в и материалов с заданными кристаллич. структурой либо степенью кристалличности (термопластичные полимеры, стекло и др.). === Исп. литература для статьи «КРИСТАЛЛИЗАЦИЯ»: Маллин Дж.У.. Кристаллизация, пер. с англ., М., 1965; Магусевич Л.Н.. Кристаллизация из растворов в химической промышленности, М., 1968; Бэмфорт А В, Промышленная кристаллизация, мер. с англ., М., 1969; Пономаренко В. Г. Ткаченко К. П., Курлянд Ю. А., Кристаллизация в псевдоожиженном слое. К., 1972; Мелихов И. В., Меркулова М.С.. Сокристаллизация, М.. 1975; Гельперин Н. И.. Носов Г. А., Основы техники кристаллизации расплавов, М., 1975; Кидяров Б. И., Кинетика образования кристаллов из жидкой фазы, Новосиб., 1979; Гельперин Н. И., Основные процессы и аппараты химической технологии, кн. 2, М., 1981, с. 678 726, Контактная кристаллизация, под ред. М.Ф. Михалева. Л., 1983; Тодес О. М., Себалло В. А.. Гольцикер А. Д., Массовая кристаллизация из растворов. Л., 1984; Гельперин Н. И., Носов Г. А.. Основы техники фракционной кристаллизации. М., 1986. И. В. Мелихов. Г. А. Носов.
Равновесие фаз и фазовые переходы
Реальные материалы представляют собой композиции, образованные несколькими химическими элементами. Взаимодействие химических элементов, образующих данный материал, может быть очень сложным, а его результат зависит от множества факторов, таких, например, как концентрация элементов, их природа, внешние параметры (давление и температура, напряженности магнитных и электрических полей и т. д.).
В основе рассмотрения вопроса о фазовом равновесии и фазовых переходах лежит понятие термодинамической фазы. Термодинамика дает определение фазы, как термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных состояний того же вещества. Примеры термодинамических фаз − твердое, жидкое, газообразное агрегатные состояния, парамагнитное и магнитоупорядоченные состояния магнетика, состояния одного и того же вещества с различным типом кристаллической структуры и т. д. Каждая из возможных фаз вещества находится в равновесии, т. е. является термодинамически устойчивой, в определенных областях значений внешних и внутренних параметров.
Изучение фазового состава, фазового равновесия и фазовых переходов является очень важной задачей, т. к. фазовый состав определяет физико-химические свойства реальных твердых тел. Часто бывает очень важно знать, возможно ли протекание какого-либо процесса и его конечный результат. Знание условий термодинамического равновесия позволяет предсказать, какие изменения возможны в данной системе.
Рассмотрим систему, состоящую из атомов нескольких элементов A, B, C, …, взаимодействующих друг с другом. Разобьем произвольно эту систему на малые области, в пределах которых имеют смысл такие понятия, как температура, давление, концентрация. Если отдельные области не различаются по составу и свойствам, то такая система физически однородна, или гомогенна.
Гетерогенными называются системы, состоящие из нескольких гомогенных областей, разделенных границей, на которой происходит скачок непрерывности изменения свойств. Гомогенная часть гетерогенной системы, отделенная от других частей границей раздела, называется термодинамической фазой. Таким образом, гомогенная система однофазна, а гетерогенная − многофазна.
Для твердых кристаллических тел важнейшим признаком фазы является ее кристаллическая решетка (атомная структура). Каждая фаза обладает своей, только ей присущей кристаллической решеткой, отличающейся от решеток других фаз либо типом, либо размерами элементарной ячейки. Существование различных кристаллических модификаций вещества носит название полиморфизма. Это явление было рассмотрено в гл. 1 применительно к оксиду кремния и углероду. Частным случаем полиморфизма является аллотропия – существование чистых элементов в различных кристаллических модификациях, которое при нормальном давлении проявляется у многих химических элементов (щелочные металлы, ряд редкоземельных металлов, титан, цирконий, кобальт, железо, уран, марганец, гафний и т. д.). Разные полиморфные и аллотропные модификации одного и того же вещества являются различными фазами.
Укажем основные типы фаз в твердом состоянии.
Химические соединения
Признаком того, что данная фаза представляет собой химическое соединение элементов, служит отличие ее кристаллической решетки от решеток, в которых кристаллизуются элементы, ее образовавшие. Типы возможных химических соединений чрезвычайно многообразны. Соединения, как правило, обладают своим собственным набором свойств. Кристаллическую решетку соединения можно рассматривать как решетку, состоящую из подрешеток, каждая из которых построена из атомов (группы атомов) одного сорта.
Твердые растворы
Твердыми растворами называются фазы переменного состава в которых кристаллическая решетка одного из компонентов (растворителя) сохраняется, а атомы других компонентов (растворенные вещества) располагаются в кристаллической решетке растворителя. Компоненты твердого раствора могут образовывать растворы с неограниченной и ограниченной растворимостью. При этом разные степени ограничения растворимости связаны с различной температурной зависимостью предела насыщения твердого раствора (предела растворимости). На основе химического элемента-растворителя возможны три типа твердых растворов:
• твердые растворы замещения, в которых атомы растворенного элемента занимают позиции атомов растворителя в узлах его решетки, т. е. замещают их;
• твердые растворы внедрения, где атомы растворенного элемента располагаются в междоузлиях кристаллической решетки растворителя. В этом случае атомы растворимого элемента должны, как правило, иметь меньший, чем у атомов растворителя, радиус и быть соизмеримы с размерами междоузлий или меньше их.
Неограниченная растворимость возможна только в случае твердых растворов типа замещения. Как правило, в этом случае атомы растворенного вещества участвуют в формировании связей того же типа, который существует в веществе-растворителе. В случае твердых растворов внедрения атомы растворенного вещества образуют связи другого типа;
• твердые растворы вычитания, которые образуются на основе химического соединения в том случае, когда один из элементов, образующих соединение, присутствует в соотношении, превышающем формульное соотношение. В этом случае такой элемент занимает в своей подрешетке соединения присущие ему позиции, а соответствующая часть позиций в подрешетке другого (других) элемента (элементов), концентрация которого меньше стехиометрической, остается незанятой (вакантной), т. е. в этой подрешетке возникают вакансии.
Рассмотренные типы твердых растворов иллюстрируют схемы, приведенные на рис. 13.1.
|
|
|
Рис. 13.1. Типы твердых растворов: а, б, в − растворитель-химический элемент (а − растворитель; б − раствор замещения; в − раствор внедрения); г, д, е − растворитель-химическое соединение (г − растворитель; д − раствор замещения; е − раствор вычитания, квадраты − незанятые узлы) [52] |
Механические смеси
Неорганические материалы могут образовывать сплавы, являющиеся, как правило, многофазными образованиями. Иногда в специальной литературе используется термин «механическая смесь», подразумевающий смесь двух и более фаз. Фазы, образующие смесь, могут представлять собой элементы или соединения. Образование смесей происходит при выделении второй фазы из пересыщенных твердых растворов [52].
Следует учитывать, что фаза, состоящая из нескольких химических элементов, может быть неоднородна по химическому составу в объемах, как сопоставимых с размерами элементарной ячейки, так и значительно больших.
Твердая кристаллическая фаза может быть получена в виде монокристалла или поликристалла. Зерна (кристаллиты) поликристалла отделены одно от другого поверхностями раздела − границами зерен − толщиной в несколько межатомных расстояний. Границы зерен называют внутрифазными границами, в отличие от межфазных границ на которых, как указывалось выше, свойства вещества терпят разрыв.
В термодинамике важное место занимает понятие компонентов системы. Под компонентами термодинамической системы понимают химические элементы или соединения, из которых может быть построена любая фаза данной системы. Таким образом, в качестве компонентов системы могут выступать индивидуальные вещества (химические элементы и соединения). Под числом компонентов системы понимают минимальное число индивидуальных веществ, из которых может быть построена любая фаза данной системы. Поэтому в общем случае число компонентов системы может быть меньше числа химических элементов, входящих в состав фазы. Например, соединения индия с мышьяком и фосфором InAs и InP образуют при смешивании непрерывный ряд твердых растворов. Химических элементов в этом растворе три, но компонентов системы только два − оба соединения, т. к. при любом составе твердого раствора InAsxP1-x суммарная атомная доля (As+P) должна быть равна атомной доле индия: In0,5As0,5-xPx, и твердый раствор любого состава может быть представлен формулой (InAs)y(InP)1-y.
Фазы гетерогенной системы могут находиться в различных агрегатных состояниях либо отличаться химическим составом или кристаллической структурой. Например, для бинарной системы, состоящей из атомов двух сортов A и B, в твердом состоянии возможны различные варианты фазового равновесия: 1) система может быть гомогенна и представлять собой твердый раствор (A, B) или химическое соединение AnBm; 2) система может быть гетерогенна и состоять из смеси кристаллов чистых элементов A и B при отсутствии растворимости в твердом состоянии или же 3) может состоять из смеси кристаллов ограниченных твердых растворов.

