
1-7 Физ химия
.docxВ
общем случае
для мембран, проницаемых для одних
сортов ионов и не проницаемых для
других, при расчете мембранный потенциал
требуется введение определенных
приближений в зависимости от толщины
мембраны, ее состава и строения, а также
от механизма переноса. В случае мембран
макроскопического размера полный
мембранный потенциал слагается из трех
компонентов: двух граничных потенциалов,
локализованных в двойных электрических
слоях на границе мембрана-раствор
электролитов, и внутримембранного,
локализованного в электронейтральном
объеме мембраны. Для системы, в которой
в фазе a имеется бинарный электролит
В+ А-, присутствующий и в мембране, а
мембрана содержит ион R с зарядовым
числом zR, не проникающий через межфазные
границы, граничный потенциал определяется
формулой Доннана и называется
доннановским: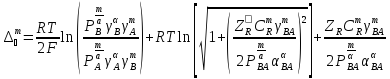 .
Здесь
cmR - концентрация ионов R в мембране, gi-
и Рi-коэффициент активности и распределения
ионов.
.
Здесь
cmR - концентрация ионов R в мембране, gi-
и Рi-коэффициент активности и распределения
ионов.
23. Гальванический элемент (химический источник тока) – устройство, которое позволяет превращать энергию химической реакции в электрическую работу. По принципу работы различают первичные (разовые), вторичные (аккумуляторы) и топливные элементы. Гальванический элемент состоит из ионпроводящего электролита и двух разнородных электродов (полуэлементов), процессы окисления и восстановления вгальваническом элементе пространственно разделены. Положительный полюс гальванического элемента называется катодом, отрицательный - анодом. Электроны выходят из элемента через анод и движутся во внешней цепи к катоду. Правила записи: слева располагается электрод, имеющий более отрицательный потенциал (анод), справа - катод; растворы отделяются вертикальной пунктирной линией, если они контактируют друг с другом, и двумя вертикальными линиями, если между ними находится солевой мостик; одна вертикальная линия означает границу раздела фаз, вертикальная пунктирная линия - мембрана.
Медно-цинковый
элемент (элемент Даниэля)
состоит из двух полуэлементов (или
электродов): I
- цинковая пластинка погружена в раствор
ZnSO4,
II
- медная пластинка - в растворCuSO4.
Полуэлементы соединены ионным мостиком
III.
При
замыкании внешней цепи IV
на аноде происходит окисление цинка:Zn
- 2е = Zn2+.На
катоде - восстановление ионов меди:Cu2+
+ 2е = Cu.E=E0+RT/nF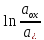 ;при
25
;при
25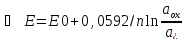 .Электродным
потенциалом
.Электродным
потенциалом
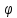 называется величина, равная ЭДС
гальванического элемента, составленногоиз
данного электрода и стандартного
водородного электрода. ЭДС электрохимического
элемента равна разности электродных
потенциалов: Е =
называется величина, равная ЭДС
гальванического элемента, составленногоиз
данного электрода и стандартного
водородного электрода. ЭДС электрохимического
элемента равна разности электродных
потенциалов: Е =
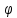 1
–
1
–
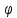 2
2
Электродный потенциал электрода считается положительным, если в гальваническом элементе со стандартным водородным электродом данный электрод является катодом, и отрицательным - если анодом.
24.Стандартный электродный потенциал измеряют соотношением стандартныого водородного электрода,потенциал которого принято считать =0.ЭДС равна разности потенциалов правого и левого электродов.Епр-Елев=Е.ЭДС>0,то реакция идет так как записана в элементе,протекает самопроизвольно.ЭДС <0,самопроизв протекает обратимая реакция.
Классификация:-электроды I рода(восстановленная форма-Ме электроды,окисленная форма-ионы этого Ме,прост или комплексы;как правило обратимые по катиону)-электроды II рода(Ме покрытые слоем его труднораств соли,погруженые в раствор содержащий анионы этой соли;восст форма- Ме и анионы соли;окисл.форма-труднораств.соль;обратимы по аниону)-О-в или редоксоэлектроды,сост из инертного Ме(Рt)который не участвует в р-ии,а является переносчиком электронов между окисл. и вост. формами вещества.-Газовые электроды,сост из инертного Ме(Рt)к которому подается газ,участвующий в электродном процессе(восст.форма-газ;окисл-ионы в р-ре)зависит от активности ионов в р-ре и от активности газа
25
см24.ЭДС
элемента связана с
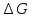 протекающей в элементе реакции
протекающей в элементе реакции
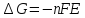 ,
,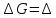 H-
H-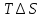 .Зная
станд.потенциал можно рассчитать
константу равновесия протекающую в
элементе реакции:K=exp(-
.Зная
станд.потенциал можно рассчитать
константу равновесия протекающую в
элементе реакции:K=exp(-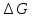 /RT)=exp(nFE0/RT).Зная
температурный коэффициент ЭДС можно
рассчитать
/RT)=exp(nFE0/RT).Зная
температурный коэффициент ЭДС можно
рассчитать
 H=
H=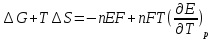
26. Перенапряжение электрохимическое, отклонение электродного потенциала от его равновесного (по отношению к приэлектродному составу раствора)термодинамического значения при поляризации электрода внешним током. При заметном удалении от равновесия перенапряжение () и плотность поляризующего тока (i) обычно связаны соотношением = а + b lg i (уравнение Тафеля), где а и b — эмпирические постоянные. Перенапряжение зависит от температуры, природы электродного материала и состава раствора.Перенапряжение необходимо для ускорения нужной электродной реакции. Если скорость электродной реакции в целом определяется скоростью собственно электрохимической стадии, связанной с переносом заряда, то перенапряжение усиливает электрическое поле, действующее на разряжающиеся частицы, благодаря чему снижается энергия активации разряда. Поскольку электрическое поле в значительной степени обусловлено строением двойного электрического слоя, перенапряжение оказывается зависящим от концентрации постороннего электролита и адсорбирующихся веществ, влияющих на распределение потенциала в двойном слое. На повышении перенапряжения основано действие многих ингибиторов коррозии металлов;перенапряжение в промышленномэлектролизе, неизбежно связанное с дополнительным расходом энергии, приводит к увеличению себестоимости продукции.
27.Процессы взаимного превращения химической и электрической
форм энергии называют электрохимическими процессами. Электрохими-
ческие процессы можно разделить на две основные группы:
1) процессы превращения химической энергии в электрическую (в гальва-
нических элементах); 2) процессы превращения электрической энергии в химическую (электро-
лиз). Электрохимическая система состоит из двух электродов и ионного
проводника между ними. Ионным проводником (проводником 2-го рода)
являются растворы или расплавы электролитов, а также твердые электро-
литы. Электродами называют проводники, имеющие электронную прово-
димость (проводники 1-го рода) и находящиеся в контакте с ионным про-
водником. Для обеспечения работы системы электроды соединяют друг с
другом металлическим проводником, который называют внешней цепью
электрохимической системы.
28.Коррозия-самрпроизвольное разрушение металла при контакте с ОС.Электрохимическая коррозия(Н20+02)определяется током самораспределения = скорости коррозии. Газовая коррозия(S02,H2S,02).Mетоды определения:-хим.анализ р-ра,газа;-потеря массы металла;-радиоактивный индикатор.
Защита от коррозии:-изоляция поверхности от влияния среды;-катодная защита(поляризация внутр источника тока);-протекторная защита(поляризац Ме при подключении менее благородного Ме)Ингибиторы:катодного типа,анодного типа,смешанного типа.
Скорость коррозии:-темперетура,-состояние растворителя,-природа электролита.На морфологию и свойства образования пленки влияют:-текстура,точечность и протяженность деффекта,включения.
Исп.кераммические материалы:NiFe2O4 +Al2O3=NiAl204+Fe2O3 распл.;Электрохим.полирование:основ на высокой реакционной способности выступающей поверхности металла;Электрохим.травление.
