
- •54. Обратимые и необратимые процессы, круговой процесс, тепловые двигатели, холодильные машины.
- •55. Цикл Карно. Максимальный кпд тепловой машины.
- •56. Технические циклы.
- •57. Второе начало термодинамики (6 формулировок).
- •58. Энтропия
- •59.Принцип возрастания энтропии
- •60. Определение энтропии неравновесной системы через статистический вес состояния. III начало термодинамики.
- •61. Метод термодинамических потенциалов (характеристических функций).
- •62. Явления переноса. Средняя длина свободного пробега молекул.
- •63. Коэффициент диффузии.
- •64. Теплопроводность. Коэффициент теплопроводности.
- •65. Уравнение теплопроводности.
- •70. Изотермы Ван-дер-Ваальса. Критич. Состояние. Внутр. Энергия реального газа.
- •71. Твёрдые тела.Теплоёмкость кристалла
- •72. Жидкости.Поверхн. Натяж. Жидк.
- •73. Смачивание и капиллярные явления
- •74. Принцип динамич. Отопления
- •75. Элементы физики полимеров
65. Уравнение теплопроводности.
Уравнение теплопроводности описывает процесс переноса тепла в одномерном случае.
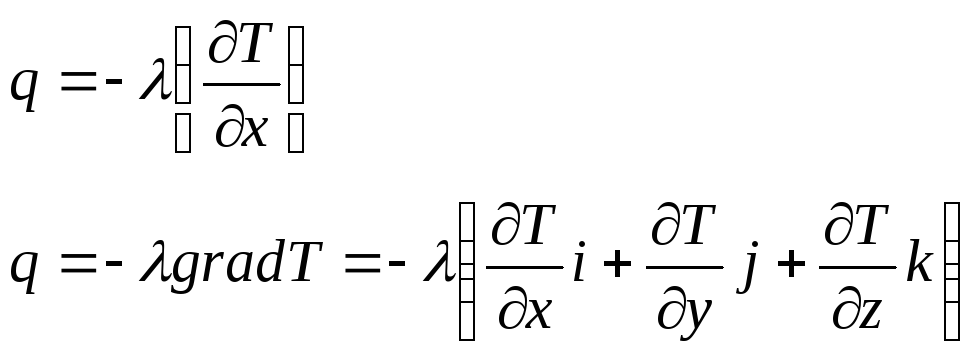
![]()
Цилиндр АВ расположен
вдоль оси х, плотность газа
![]() длина
поперечного сечения
длина
поперечного сечения
![]()
Тепло, поступающее
в цилиндр за время dt
через основание А равно:
![]()
Тепло, выходящее из цилиндра
![]()
Тепло, поступающее в цилиндр АВ
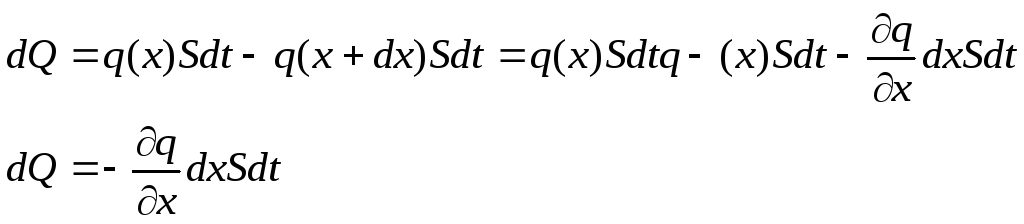
С другой стороны
это тепло можно представить виде :
![]()
dm-
масса газа :
![]()
с-удельная
теплоемкость :
![]()
Приравниваем
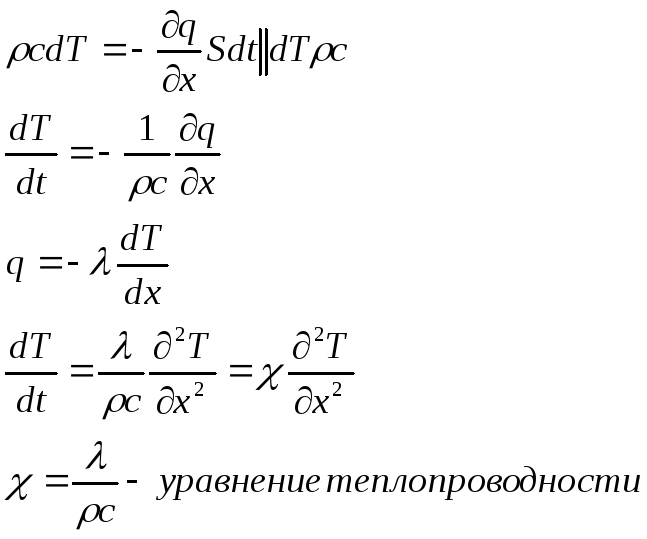
В двумерном
![]()
К уравнению теплопроводности необходимо задать граничные и начальные условия, тогда приходим к краевой задачи Коши:
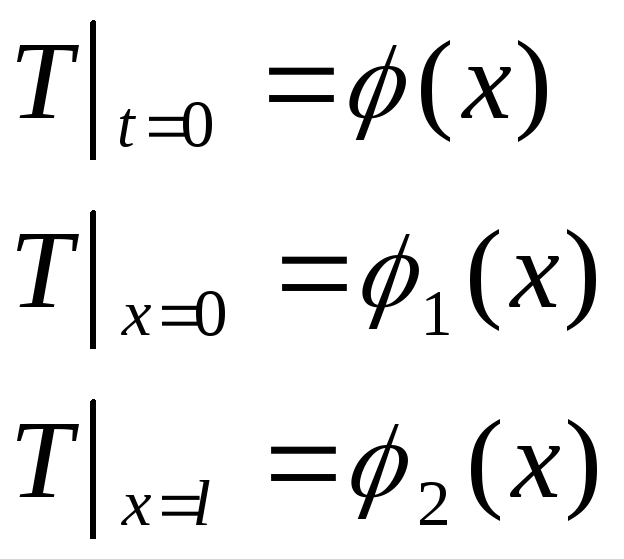
66 - 69
70. Изотермы Ван-дер-Ваальса. Критич. Состояние. Внутр. Энергия реального газа.
У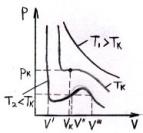 р-ние
ВдВ явл. ур-нием относит. объёма V:
р-ние
ВдВ явл. ур-нием относит. объёма V: ![]() (умножим
рав-во на
(умножим
рав-во на ![]() )
Кубич. ур-ние имеет 3 корня (либо все
корни действит., либо 1-о действит., а 2
комлексно-сопряжённых
)
Кубич. ур-ние имеет 3 корня (либо все
корни действит., либо 1-о действит., а 2
комлексно-сопряжённых ![]() )
Уравнение для изотерм ВдВ им. вид:
)
Уравнение для изотерм ВдВ им. вид:
При некот. Тк изотерма буд. иметь точку перегиба.Изотерма реального газа отлич. от изотерм ВдВ. Волнообразн. участок ур-ния
ВдВ замен-ся на линейный (экспериментально получил Эндрюс):
П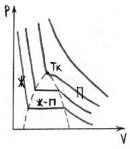 ри
темпер >Тк
вещ-во
существ. только в газообразн. сост. и
никаким сжатием
нельзя его
перевести в жидк. состояние.Найдём
внутр. энергию реал. газа (ВдВ) Внутр.
энергия складыв. с кинетич. и потенц.
энергии, т.е.
ри
темпер >Тк
вещ-во
существ. только в газообразн. сост. и
никаким сжатием
нельзя его
перевести в жидк. состояние.Найдём
внутр. энергию реал. газа (ВдВ) Внутр.
энергия складыв. с кинетич. и потенц.
энергии, т.е. ![]() ;
ν=1 моль;
;
ν=1 моль; ![]() ;
p*
;
p*![]() (избыточн. внутр. давл.)Работа на преодол.
сил сцепл. молекул идёт на увелич.
потенц. энергии реал. газа δА=р*
(избыточн. внутр. давл.)Работа на преодол.
сил сцепл. молекул идёт на увелич.
потенц. энергии реал. газа δА=р*![]() ;
А=
;
А=![]() =
=![]() =‒
=‒![]() +const=Ep
(const=0);
внутр.энерг.ид.газа
+const=Ep
(const=0);
внутр.энерг.ид.газа ![]() =
=![]()
71. Твёрдые тела.Теплоёмкость кристалла
Тв. тела отлич. от
газообр. и жидкю постоянством формы,
V. Они делятся на кристаллич. и
аморфные.Большее число тв. тел
кристалл-кие. Для кристаллов харак-но
наличие кристаллич. решётки. Кристалл
как правило проявл. анизотропные физ.
св-ва (разные по разным направл.) Аморфные
тела – переохлажд. жидкости(стекло,
смола, битум). Они проявл. изотропные
св-ва. Вычислим теплоёмк. кристалла.Т.к.
V тв. тел маломеняется, то теплоёмк Cp
и CV
примерно
одинаковы и можно говорить просто о
теплоёмкости С. Внутр. энергия крист.
решётки тв. тела сост. из кинетич. и
потенц. энергии атомов и ионов в узлах
этой решётки. При этом на кажд. степ.
свободы приход-ся ![]() kT
в виде кинетич. энергии и
kT
в виде кинетич. энергии и ![]() kT
в виде потенц. энергии.
kT
в виде потенц. энергии. ![]() kT+
kT+![]() kT=kT.
Т.к. атом имеет 3 степ. свободы, то энергия
атома будет 3kT.
Так как 1 моль содерж NА
атомов, то внутр. энергия U= NА
kT=kT.
Т.к. атом имеет 3 степ. свободы, то энергия
атома будет 3kT.
Так как 1 моль содерж NА
атомов, то внутр. энергия U= NА![]() 3kT=3RT.
Теплоёмкость С=
3kT=3RT.
Теплоёмкость С=![]() =
=![]() +
+![]() (
(![]() =0);
C=3R
≈25
=0);
C=3R
≈25 ![]()
З-н Дюлонга и Пти (1815). «Молярн. теплоёмк. кристаллич. атомарных тел одинакова и равна 3R».
П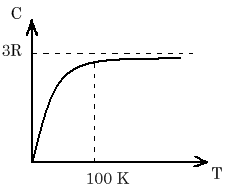 ри
низк. темпер. наблюд. отклонение от з-на
Дюл. и Пти, при этом происх. постеп.
«вымерзание» колебательн. степеней
свободы.При низк. темп. теплоёмк. мен-ся
по з-ну С= const∙
ри
низк. темпер. наблюд. отклонение от з-на
Дюл. и Пти, при этом происх. постеп.
«вымерзание» колебательн. степеней
свободы.При низк. темп. теплоёмк. мен-ся
по з-ну С= const∙![]() (з-н
П.Дебая)
(з-н
П.Дебая)
На графике з-н Дебая им. вид:
