
- •1. Энергетика химических реакций. Что изучает химическая термодинамика?
- •2. Перечислите, какие вы знаете системы. Как называются реакции по тепловым эффектам?
- •3. Дайте понятия процессам: изобарный, изохорный, изотермический.
- •4. Что такое энтальпия образования?
- •5. Что такое термохимическое уравнение? Некоторые особенности термохимических уравнений
- •6. Закон Гесса, следствие из закона Гесса. Постулат Лавуазье Лапласса. Формулировка закона
- •8. Как для реакций, в которых участвуют газообразные вещества, без таблиц можно определить изменение энтропии?
- •11. Химическое равновесие и константа равновесия. От каких факторов зависит константа равновесия? Уравнение, связывающее термодинамические параметры и константу равновесия?
- •12. Принцип Ле-Шателье. Куда сместится равновесие при повышении и понижении давления, температуры и концентрации? При введении катализатора?
- •13. Дать понятие скорости химических реакций. Какие простые реакции Вы знаете? Привести примеры. Мономолекулярные, бимолекулярные и тримолекулярные реакции. Привести примеры.
- •14. Какие сложные реакции Вы знаете? Привести примеры последовательных, параллельных и цепных реакций. Чем отличаются сложные реакции от простых.
- •15. Гомогенные и гетерогенные реакции. Какие вещества не входят в кинетическое уравнение?
- •16. Закон действующих масс, формулировка. Написать любую реакцию и ее кинетическое уравнение.
- •21. Что такое катализ? Что такое гомогенный и гетерогенный катализ? Привести пример расчета во сколько раз увеличится скорость реакции с катализатором и без катализатора?
- •22. Какие электрохимические процессы Вы знаете?
- •24. Рассмотреть работу гальванического элемента на примере элемента Даниэля Якоби. Принцип составления схемы гальванического элемента. Как рассчитывается эдс гальванического элемента.
- •25. Концентрационный гальванический элемент, принцип работы и расчет эдс. Привести пример.
- •26. Что такое электролиз? Какие бывают электроды? Электролиз расплава. Привести пример.
- •27. Электролиз растворов. Привести все случаи в зависимости от активности металлов.
- •28. Анодное окисление. Привести примеры. Электролиз с растворимым анодом. Закон Фарадея. Выход по току. Напряжение разложения. Перенапряжение.
- •29. Коррозия. Химическая и электрохимическая. Привести пример электрохимической коррозии. Что такое протекторная защита?
- •30. Растворы. Коэффициент растворимости. Способы выражения концентрации растворов.
- •31. Свойства растворов не электролитов. От чего зависят коллигативные свойства? Первый закон Рауля. Второй закон Рауля. Явление осмоса. Осмотическое давление.
- •32. Свойства растворов электролитов, характеристики растворов электролитов: степень электролитической диссоциации. Константа диссоциации. Закон разбавления Оствальда.
- •33. Понятие изотонического коэффициента и формулы расчета коллигативных свойств для электролитов. Связь степени электролитической диссоциация и изотонического коэффициента.
- •34. Ионно-обменные реакции, полные и сокращенные. Направление протекания ионно-обменных реакций.
- •2 Примеры записи реакций ионного обмена
- •35. Электролитическая диссоциация воды, водородный показатель (рН). Расчет водородного показателя.
- •36. Гидролиз. Понятие и типы гидролиза. Степень гидролиза. Факторы, влияющие на степень гидролиза. Константа гидролиза.
- •37. Что такое произведение растворимости? Показать на примере.
14. Какие сложные реакции Вы знаете? Привести примеры последовательных, параллельных и цепных реакций. Чем отличаются сложные реакции от простых.
Параллельными реакциями называются реакции вида:т.е. при которых одни и те же исходные вещества, одновременно реагируя между собой образуют разные продукты.
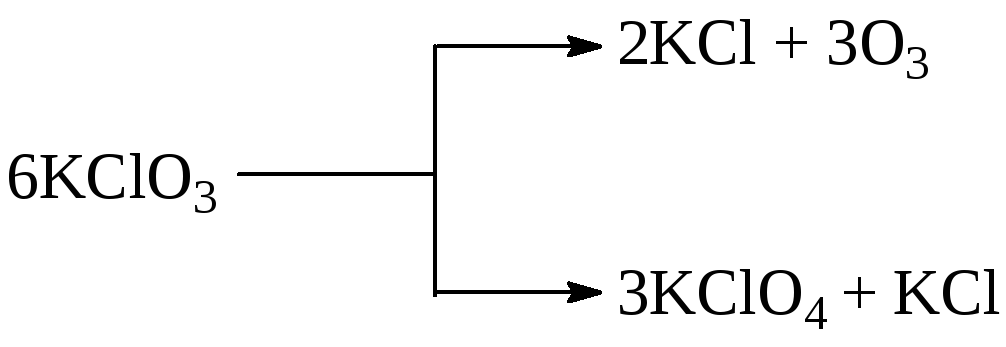
Последовательными называются такие реакции, в которых образование конечного продукта из исходных веществ происходит не непосредственно, а обязательно через ряд промежуточных стадий, протекающих одна за другой в строго определённой последовательности.
Однако, если одна из стадий последовательной реакции обладает значительно меньшей скоростью чем все остальные, то общая скорость реакции будет определяться скоростью именно этой стадии, которая в данном случае называется лимитирующей.
Например, реакция хлорирования оксида азота (II)
2NO+Cl2= 2NOCl
состоит из двух стадий:
1) NO + Cl2 = NOCl2;
2) NOCl2 + NO = 2NOCl
Цепными называют химические реакции, протекающие через ряд регулярно повторяющихся элементарных стадий с участием активных частиц, содержащих в своём составе атомы с неспаренными электронами на внешнем энергетическом уровне (или по другому – свободных радикалов).
Например в реакции синтеза хлороводорода и водорода и хлора, протекающей по цепному механизму (Н2+Cl2= 2HCl) возникновению цепи соответствует процесс
Cl2![]() 2∙Сl
2∙Сl
Развитие цепи представляет собой периодическое повторение стадий реакции, с участием образовавшихся радикалов. Они иначе называются звеньями цепи:
Н2+ ·Cl→HCl+˙H
˙H+Cl2→HCl+˙Cl
H2+˙Cl→HCl+˙H
Cl2+˙H→HCl+˙Clи т.д.
15. Гомогенные и гетерогенные реакции. Какие вещества не входят в кинетическое уравнение?
По фазовому состоянию реагентов реакции бывают гомогенные (однородные) игетерогенные(неоднородные). В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе (газовой, жидкой или твердой). Зоной реакции при проведении гомогенных реакций служит весь реакционный объем. В гетерогенных процессах реагенты, принимающие участие в реакции, находятся в разных фазах. В реакционном объеме одновременно находятся две или более фазы, а химическая реакция протекает на границе раздела фаз или в объеме одной из фаз.
Гетерогенные двухфазные реакциив зависимости от агрегатного состояния исходных веществ бывают следующих типов: 1. в системе «газ – твердое тело»; 2. между двумя несмешивающимися жидкостями; 3. в системе «газ – жидкость»; 4. в системе «жидкость – твердая фаза».
Гетерогенные системы бывают также трехфазными.
Твердые вещества не входят в кинетическое уравнение
16. Закон действующих масс, формулировка. Написать любую реакцию и ее кинетическое уравнение.
Закон
действующих масс -
скорость химической реакции пропорциональна
произведению концентраций реагирующих
веществ

17. Как графическим способом определяется кинетический порядок реакции (нулевой, первый, второй).

18. Влияние давления и концентрации на скорость химических реакций. Какие факторы влияют на константу скорости химических реакций.
Давление сильно влияет на скорость реакций с участием газов, потому что оно непосредственно определяет их концентрации (закон действующих масс). Факторы, влияющие на константу скорости:
Природа реагентов
Направление реакции (природа продуктов)
Температура
19. Влияние температуры на скорость химических реакций. Правило Вант-Гоффа.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением
![]()
ɣ - температурный коэффициент скорости реакции. Этот коэффициент есть отношение констант скоростей при температуре t+10 и t.
20. Дать понятие энергии активации. Уравнение Аррениуса. Расчетный и графический метод определения энергии активации.
Энергия активации (Еа) - энергия, необходимая для достижения системой переходного состояния, называемого активированным (или переходным) комплексом, который превращается в продукты реакции уже самопроизвольно
Уравнение Аррениуса:
![]() ,
Здесь A –
предэкспоненциальный множитель, R –
универсальная газовая постоянная, T –
абсолютная температура.
,
Здесь A –
предэкспоненциальный множитель, R –
универсальная газовая постоянная, T –
абсолютная температура.
,
![]()
Графический метод определения энергии активации. Необходимо иметь несколько значений k при разных T, чтобы построить график ln k = f(T).
![]()
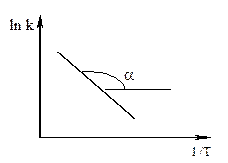
Здесь
tg a = ![]() .
.
